以下是某化学小组探究的过程.
向NaOH溶液中滴入紫色石蕊溶液,溶液呈蓝色.
请在下列横线上填写适当的内容.
[提出问题]是什么粒子使紫色石蕊溶液呈蓝色呢?
[查找资料]NaOH溶液中存在的粒子有大量的H2O、Na+、OH-和极少量的H+.
[猜想]是大量的OH-使紫色石蕊溶液呈蓝色.
[实验探究步骤及其说明]
(1)在一支干净的试管中加入2mL蒸馏水,再滴入几滴紫色石蕊溶液,紫色石蕊溶液几乎不变色,说明________________________.
(2)在一支干净的试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊溶液,紫色石蕊溶液几乎不变色,说明________________________.
(3)________________________________________________________________________.
[结论]原猜想________.(填“成立”或“不成立”)
CO2是初中化学重点研究的气体之一,某化学兴趣小组设计了如下实验来探究CO2的制取和性质。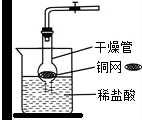
该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如图所示,在干燥管内的铜网上应盛放;若将铜网换成铁网,可能产生的后果是___________________________,其原因是(用化学方程式表示)__________________。
小红的家庭化学实验室有如下物品:①试管②导管与橡皮塞③煤气和煤气炉④托盘天平⑤筷子⑥铁钉⑦铜丝⑧食盐⑨食醋⑩石灰水11硫酸铜12水请你与小红一起完成如下实验:
(1)若要探究氧气的助燃性,需要用到的物品是(填序号)_____________;
(2)若要探究铁钉锈蚀的条件,除上述物品外,还需要的物品是_________;
(3)若要利用上述物品证明铁的活动性比铜强,写出实验中发生反应的化学方程式____________________,该反应所属基本类型是______________;
(4)请利用上述物品设计实验,探究加速食盐溶于水的某一方法的有效性,我的实验方案是:__________。
某化学兴趣小组设计了如图所示的装置,对纯碱(Na2CO3)和小苏打(NaHCO3)两种固体进行实验探究
(1)写出甲、丙两种仪器的名称:_________,_________
(2)在实验过程中,观察到乙仪器中的澄清石灰水变浑浊,请写出丙仪器中发生反应的化学方程式____________________________。
(3)该实验探究利用的科学方法是______________(填“控制变量法”、“对比观察法”或“定量分析法”),实验目的是____________________________。
某化学活动小组的同学,设计了如下图所示实验,请回答:
(1)猜想该实验探究的问题是___________________________________
(2)写出发生反应的化学方程式__________________________________
(3)该实验能验证的结论为_____________________________________.
有些反应有明显的现象,有些反应必须借助一定的装置来判断反应是否发生,在CO2和NaOH是否发生变化时,某校小组的同学了以下四种装置。
回答下列问题:
(1)请简单描述上述四种装置中的现象:
A____________________
B ____________________
C ____________________
D ____________________
(2)上述四种所依据的共同原理是___________________
(3)如果有同学质疑,认为上述没有排除二氧化碳溶解于氢氧化钠溶液的假设,你如何进一步证明CO2和NaOH肯定发生了反应?