某化学兴趣小组为了测定某黄铜(铜锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
第六次 |
| 加入稀硫酸的质量(g) |
10 |
10 |
10 |
10 |
10 |
10 |
| 剩余固体的质量(g) |
9.35 |
8.7 |
8.05 |
7.4 |
6.75 |
6.75 |
(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)
(2)所用稀硫酸的溶质质量分数为多少?
实验室现有500 g质量分数为98%的浓硫酸,其中溶质的质量是__________g。要将其稀释为10%的稀硫酸,需要加入水的质量__________g。
某小组利用下列实验数据,计算金属M的相对原子质量。已知金属M和硫酸反应的化学方程式为: M + H2SO4 ="=" MSO4 + H2↑。现取20 g该金属样品于烧杯中,然后向其中加入稀硫酸,实验数据记录如下: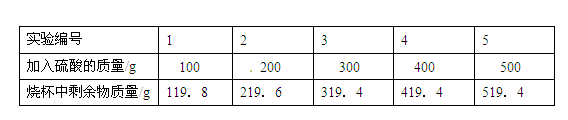
第5次实验后,烧杯中还有0.5 g剩余固体。
(1)原金属样品中M的质量
(2)计算该金属的相对原子质量。
(6分)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:
取废液桶上层清液共11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:
(1)通过右图可知,当碳酸钠溶液质量加到kg时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)此时所得溶液能否用于该校生物兴趣小组的小麦选种(选种液要求氯化钠的溶质质量分数在10%~20%之间)?请通过计算回答。
某同学设计了一套如下图所示的装置,并用该装置测定粗锌样品的含锌量。
(1)称量10.0g粗锌放在铜网中,按图将仪器组装好以后,称得仪器和药品总质量为120.0g。
(2)将铜网插入足量稀盐酸中,充分反应,可以观察到的实验现象为,
反应的化学方程式为。
(3)反应完全后,称得装置总质量为119.8g。则粗锌的纯度为。
(4)该实验中碱石灰的作用是干燥剂,同时防止稀盐酸挥发出的氯化氢气体逸散到空气中。
若不用碱石灰,则所测定的粗锌纯度(填“偏大”、“偏小”或“无影响”;
不考虑空气中CO2和H2O对实验的影响)。
(5)若将粗锌换成石灰石,原实验方案(填“能”或“不能”)用于石灰石
样品纯度的测定,理由是。
6分)用右图微型仪器完成制取并检验CO2的实验只消耗了0.73g10%的盐酸。求:。
(1)产生CO2的质量是多少克?(结果保留三位小数)
(2)如果10%的盐酸密度为1.1g/mL,消耗盐酸的体积是
mL。(结果保留一位小数)