为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示: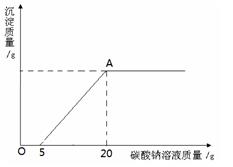
根据题中有关信息和图像分析回答下列问题:
(1)原废液中的溶质成分有 (用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
某中学化学兴趣小组为探究实验室制取氧气。把干燥、纯净的氯酸钾和二氧化锰的混合物30g装入大试管中,加热。待反应完全后,将试管冷却、称量,得到20.4g固体物质。试计算:
(1)完全反应后制得氧气多少克?
(2)原混合物中氯酸钾的质量分数。(计算结果用百分数表示,保留到小数点后一位数字)
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱。某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3。为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3 Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。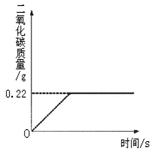
请解答下列问题:
(1)反应过程中生成二氧化碳的质量为g
(2)100g混合物中NaHCO3的质量;
黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品,将40g19.6%的稀硫酸分四次加入,实验结果如下表:
| 19.6%r的硫酸/g |
10g |
10g |
10g |
10g |
| 生成的氢气/g |
0.04g |
0.04g |
Xg |
0. 02g |
(1)X的值是g
(2)该黄铜样品中铜的质量分数。
已知 Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl 组成的固体混合物。向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题: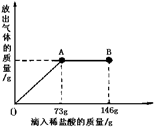
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH7(填>、=、<)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
人体缺乏维生素C(简写“Vc”)会患坏血病。右图所示为某种“维生素C”说明书的一部分,请回答:
(1)“Vc”中碳、氢、氧三种元素质量比为;
(2)若正常成人每天对“Vc”的最低需要量为60mg:当这些“Vc”完全来自右图的“维生素C”时,则每次服用“维生素C”至少片;