某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是()
| 选项 |
实验及现象 |
结论 |
| A |
将湿润的红色石蕊试纸放在试管口,试纸变蓝 |
反应中有产生 |
| B |
收集产生的气体并点燃,火焰呈淡蓝色 |
反应中有产生 |
| C |
收集气体的同时测得溶液的pH为8.0 |
弱碱性溶液中也可被氧化 |
| D |
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 |
弱碱性溶液中氧化了 |
下列递变规律正确的是
| A.O、S、Na、K原子半径依次增大 |
| B.Na、Mg、A1、Si的还原性依次增强 |
| C.HF、HCl、H2S、PH3的稳定性依次增强 |
| D.KOH、Ca(OH)2、Mg(OH)2、A1(OH)3的碱性依次增强 |
下列变化中,属于吸热反应的是
| A.木炭燃烧反应 | B.酸碱中和反应 |
| C.铝和盐酸反应 | D.氢氧化钡晶体和氯化铵晶体反应 |
在某无色透明的酸性溶液中,能大量共存的离子组是
| A.Na+、K+、SO42-、HCO3- | B.Cu2+、K+、SO42-、NO3- |
| C.Na+、K+、Cl-、NO3- | D.Ba2+、K+、SO42-、Cl- |
下列反应中,属于加成反应的是
在右图所示的原电池中,负极发生的反应是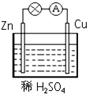
| A.Cu2+ + 2e- ="=" Cu | B.Cu-2e- ="=" Cu2+ |
| C.2H+ + 2e- ="=" H2↑ | D.Zn-2e- ="=" Zn2+ |