25℃时,在10浓度均为0.1和混合溶液中,滴加0.1的盐酸,下列有关溶液中粒子浓度关系正确的是
| A. | 未加盐酸时: |
| B. | 加入10 盐酸时: |
| C. | 加入盐酸至溶液 =7时: |
| D. | 加入20 盐酸时: |
研究下表信息可直接得出的结论是
| 元素 |
F |
Cl |
Br |
I |
||||
| 氢化物组成 |
HF |
HCl |
HBr |
HI |
||||
| 氢化物形成难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2与Br2混合,加热发生化合 |
H2、I2混合,加热化合,同时又分解 |
||||
| 氢化物热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定
|
将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是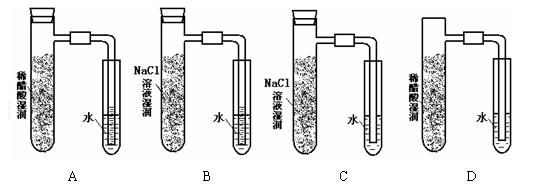
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2 + C6  CoO2 + LiC6
CoO2 + LiC6 ,下列说法正确的是
,下列说法正确的是
| A.充电时,电池的负极反应为 LiC6 - e- ="=" Li + C6 |
| B.放电时,电池的正极反应为 CoO2 + Li+ + e- ="=" LiCoO2 , |
| C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 |
| D.锂离子电池的比能量(单位质量释放的能量)低 |
根据盖斯定律判断下图所示的物质转变过程中,正确的等式是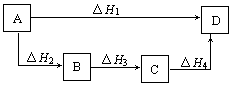
A.△H1=△H2=△H3=△H 4 4 |
B.△H1+△H2=△H3+△H4 |
| C.△H1+△H2+△H3=△H4 | D.△H1=△H2+△H3+△H4 |
对于一定不能自发进行的反应来说,反应后体系的
| A.混乱度减少,而能量增加 | B.混乱度增大,而能量降低 |
| C.混乱度减少,能量降低 | D.混乱度增大,能量增加 |