是常见的六种元素。
(1)
位于元素周期表第周期第族。
(2)
的基态原子核外电子排布式为;
的基态原子最外层有个电子。
(3)用">"或"<"填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| 金刚石晶体硅 |
|
(4)常温下,将除去表面氧化膜的
、
片插入浓
中组成原电池(图1),测得原电池的电流强度(
)随时间(
)的变化如图2所示,反应过程中有红棕色气体产生。
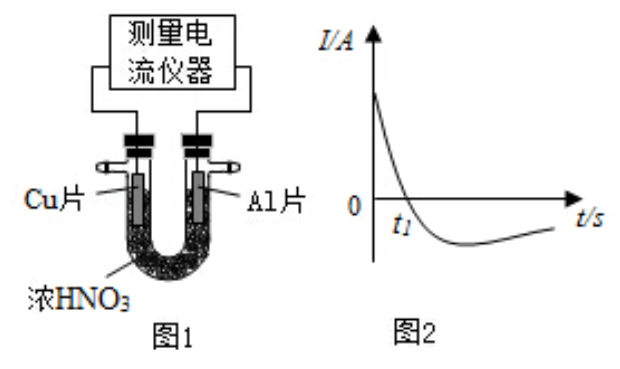
0- 时,原电池的负极是 片,此时,正极的电极反应式是,溶液中的 向极移动, 时,原电池中电子流动方向发生改变,其原因是。
用如图所示装置可以收集以下几种气体(烧瓶位置不动)(填字母,下同);
①H2②SO2③CH4④ HCl ⑤ NH3⑥ NO⑦H2S
(1)若烧瓶是干燥的,则由A口进气,可收集到的气体有,由B口进气,可收集的气体有。
(2)若在烧瓶中充满水,可收集的气体有,气体由口进入。
(3)若此装置用于净化气体,在烧瓶内装有洗涤液,则混合气体应由口进入。
在下列事实中,什么因素影响了化学反应速率?
①天的食品易霉变,冬天就不易发生该现象。
②熔化的氯酸钾放出气泡较慢,撒入少量二氧化锰很快产生气体。
③工业上常将固体燃料粉碎,以提高燃烧效率。
④同体积、同浓度的盐酸与同样大小的锌条和镁条反应,产生气体前慢后快。
⑤同体积、同浓度的硫酸和盐酸与同样大小质量相等的锌粒反应,产生气体前者快。
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效的催化剂
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=______mol·L-1·min-1。
(2)如图中4~5min之间该反应________(填“是”或“否”)处于平衡状态,判断理由________________________________________________________________________。
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,X、Z为同一主族,Y、Z两种元素的质子数之和为W、X两种元素质子之和的3倍。由此可知元素W为,X为 ,Y为,Z。上述元素中任意三种元素组成的既含有离子键又含有共价键的化合物化学式为(至少写三种)。能形成共价化合物的化学式有、、、。