"张-烯炔环异构反应"被《 》收录。该反应可高效构筑五元环化合物:

(表示氢、烷基或芳基)
合成五元环有机化合物的路线如下:

(1)属于炔烃,其结构简式是。
(2)由碳、氢、氧三种元素组成,相对分子质量是30。的结构简式是
(3)含有与相同的官能团,是芳香族化合物,中含有的官能团是
(4)与试剂反应生成的化学方程式是 ;试剂是 。
(5)和均为不饱和醇。的结构简式是
(6)为顺式结构,写出和生成I(顺式结构)的化学方程式:。
m mL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状况(常温、常压)气体体积共缩小2m mL,这三种烃可能的组合是________ 、_____________、 ______________(写三组)
(1)分别写出相对分子质量为128、72的烃的分子式:______、_ ___、__ ___(可不写满,也可补充)
(2)立方烷的结构简式如图所示,每个顶点是一个碳原子。则: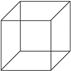
①其分子式为_____________。②它的一氯取代物有_____________种。③它的二氯取代物有_____________种。
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体。
(1)化合物I的结构简式是__________________,反应B→C的化学方程式是__________________;
(2)设计实验证明H中含有溴原子,还需用到的试剂有___________________________;
(3)为验证E→F的反应类型与E→G不同,下列实验方法切实可行的是_________________。
| A.向E→F反应后的混合液中加入硝酸酸化,再加入AgNO3溶液得到淡黄色沉淀 |
| B.向E→F反应后的混合液中加入溴水,发现溴水立即褪色 |
| C.向E→F反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,溶液褪色 |
| D.向E→F反应后的混合液中加入酸性KMnO4溶液,混合液红色变浅 |
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式:;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为。
(14分)A、B、C、D都是中学化学常见物质或离子,其中A、B、C均含有同一种元素,在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去,其他产物都已列出)。请按要求回答下列问题:
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为_____________________。(4)若D是酸,则一定是多元酸,所以ABCD 分别是
(2)若A常用作致冷剂,B和D为空气的主要成分,则反应(III)的化学方程式为__________。
(3)若D为氯碱工业的重要产品,反应(III)的离子方程式为____________________________。
(4)若D为酸或酸性气体,也能实现上面的转化,请按A、B、C、D顺序写出合理的任意一组物质的化学式。
①当D为酸时,A________、B_________、C_________、D__________。
②当D为酸性气体时,A________、B_________、C_________、D__________。