工业上将和以1:2的物质的量之比配成溶液,再通入,可制取,同时放出。在该反应中()
| A. | 硫元素既被氧化又被还原 |
| B. | 氧化剂与还原剂的物质的量之比为1:2 |
| C. | 每生成1 ,转移4 电子 |
| D. | 相同条件下,每吸收10 就会放出2.5 |
下列实验操作中正确的是( )
| A.制取溴苯:将铁屑、溴水、苯混合加热 |
| B.实验室制硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 |
| C.用浓硫酸与乙醇混合液共热控制在170℃制乙烯气体 |
| D.用浓溴水可以除去苯中混有的苯酚 |
下列关于有机物的叙述正确的是( )
| A.少量二氧化碳通入苯酚钠溶液中生成的是碳酸钠 |
| B.在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 |
| C.苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D.乙醇可与水以任意比例混溶,是因为与水形成了氢键 |
用下图所示装置检验乙烯时不需要除杂的是( )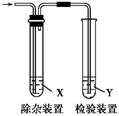
| 乙烯的制备 |
试剂X |
试剂Y |
|
| A |
CH3CH2Br与NaOH乙醇溶液共热 |
H2O |
KMnO4酸性溶液 |
| B |
CH3CH2Br与NaOH乙醇溶液共热 |
H2O |
Br2的CCl4溶液 |
| C |
C2H5OH与浓H2SO4加热至170 ℃ |
NaOH溶液 |
KMnO4酸性溶液 |
| D |
C2H5OH与浓H2SO4加热至170 ℃ |
NaOH溶液 |
Br2的CCl4溶液 |
下列鉴别方法不可行的是( )
| A.用溴水鉴别苯酚溶液、2,4-已二烯和甲苯 |
| B.用金属钠可区分乙醇和乙醚 |
| C.用水鉴别乙醇、甲苯和溴苯 |
| D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
质量相等的下列有机物充分燃烧耗氧量最大的是( )
| A.C2H6 | B.C2H2 | C.C4H6 | D.C4H8 |