)甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
完成下列填空:
1.将4.00 甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100 的硫酸滴定,至终点时耗用硫酸20.00 。
甲醛水溶液的浓度为。
2.上述滴定中,若滴定管规格为50,甲醛水溶液取样不能超过。
3.工业甲醛含量测定的另一种方法:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定。
+ → + + → + 已知能氧化甲酸生成二氧化碳和水。
如果用量不足,会导致甲醛含量的测定结果 (选填"偏高"、"偏低"或"不受影响"),因为;如果过量,会导致甲醛含量的测定结果 (选填"偏高"、"偏低"或"不受影响"),因为 。
4.甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
+ +↓ + 若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
+↓ + 若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
①主要仪器:试管 酒精灯
②可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:进行微量实验:如图所示,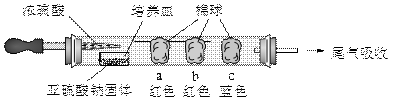
将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a.b.c三个棉球变化如下表.
请完成下列表格:
| 棉球 |
棉球上滴加试剂 |
实验现象 |
解释或结论 |
| a |
_______________ |
棉球变白,微热后又恢复红色 |
解释:__________________ 结论:该气体具有漂白性. |
| b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: _________________________ |
| c |
淀粉和I2 的混合溶液 |
棉球变为白色 |
结论:该气体具有________. |
(1)纳米材料二氧化钛(TiO2)可做优良的催化剂.
据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下: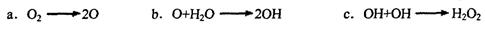
①b中破坏的是__________ (填“极性共价键”或“非极性共价键”).
②H2O2能清除路面空气中的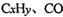 等,其主要是利用了H2O2的作用是_____________________________________________ (填“氧化性”或“还原性”).
等,其主要是利用了H2O2的作用是_____________________________________________ (填“氧化性”或“还原性”).
(2)某固体混合物中含有Na+、K+、Mg2+和Cl-、Br-五种微粒.
I.欲将钠、钾、镁三元素大致分离开来,并将氯、溴两元素大致分离开来,有以下方法和操作步骤可供选择(其中有的步骤可选两次).
①溶于水制成稀溶液;②溶于水制成浓溶液;③通入足量CO2;④加入足量 氯水;
氯水;
⑤通入足量氨气;⑥过滤;⑦用四氯化碳萃取.
选取最合理的方法和步骤:(按顺序先后填写编号).
II.分离后剩余的水溶液中所含的主要物质是.
III.在上述分离过程中分离出一种化合物晶体.欲得到干燥的该化合物固体,有两种方法可供选择:①.加热蒸发掉水分;②.将过滤得到的固体物质自然风干.正确的方法应选择______________________________________________.
实验室制氢氧化铁胶体将滴入 中,继续加热至液体呈红褐色时,用一束可见光照射可观察到现象,这一现象叫丁达尔现象,向胶体中逐滴滴入稀硫酸至过量可观察到现象,产生此现象的原因是。
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:
_____NaIO3+_______NaHSO3——_______NaHSO4+_____ Na2SO4+___I2+____H2O
(1)配平上述反应方程式并用双线桥标出电子转移的方向和数目
(2)反应中 元素被氧化,是氧化剂
(3)反应中,所得氧化产物和还原产物的质量之比为 。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.结晶法 | C.分液法 | D.蒸馏法 E.过滤法 |
⑴分离饱和食盐水与沙子的混合物。
⑵分离水和汽油的混合物。
⑶分离四氯化碳(沸点为76.75℃)和甲苯的混合物(沸点为110.6℃)的混合物。
⑷从碘的水溶液里提取碘。