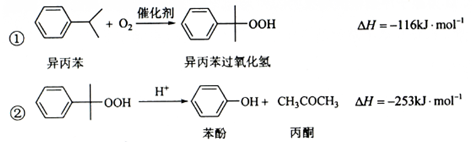
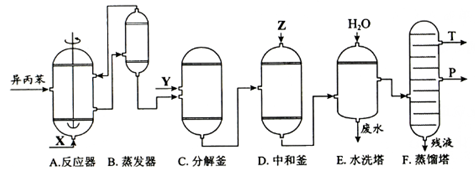
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
相关化合物的物理常数
| 物质 |
相对分子质量 |
密度() |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器中通入的是。
(2)反应①和②分别在装置和中进行(填装置符号)。
(3)在分解釜中加入的为少置浓硫酸,其作用是,优点是用量少,缺点是。
(4)反应②为(填"放热"或"吸热")反应。反应温度控制在50-60℃,温度过高的安全隐患是。
(5)中和釜D中加入的Z最适宜的是(填编号。已知苯酚是一种弱酸)。
a. b. c. d.
(6)蒸馏塔中的馏出物和分别为和,判断的依据是。
(7)用该方法合成苯酚和丙酮的优点是。
将下列家庭常用药物与相应作用连线。
板蓝根冲剂伤口消炎
甘草片退热止痛
红霉素抑制胃痛、助消化
扑尔敏抗菌消炎
阿司匹林治疗感冒
碘酒镇咳化痰
胃舒平抗过敏
在 中用虚线标示出氨基酸形成肽键时断裂化学键的位置。
中用虚线标示出氨基酸形成肽键时断裂化学键的位置。
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。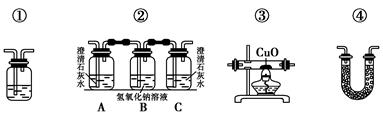
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________;B瓶溶液的作用是________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________;装置①中所盛的是________,作用是______________________。
(5)装置④中所盛的固体药品是________,它可以验证的产物是________。
(6)尾气应如何处理?_________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。
在下列各组气体中,试分析判断哪种气体更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④邻二甲苯、对二甲苯;⑤甲烷、乙烷;⑥丁烷、异丁烷
已知M2+3d轨道上有5个电子,试推出:
(1)M原子的核外电子排布。
(2)M原子的最外层和最高能级组中电子数各为多少?
(3)M元素在周期表中的位置。