(1 6分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为
(4)250C、101 kPa时,
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+="2" VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为 g/L。
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为Cu0/Zn0/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是 。
| A.CO和H2的物质的量浓度比是1:2 |
| B.CO的消耗速率等于CH3OCH3的生成速率的2倍 |
| C.容器中混合气体的体积保持不变 |
| D.容器中混合气体的平均摩尔质量保持不变 |
E.容器中棍合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(3)复合催化剂的制备方法之一是Na2 C03共沉淀法:制备1 mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1 mol/L的Na2C03水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。请写出上述过程中硝酸铝与Na2C03水溶液反应的离子方程式:
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
(共10分)如图表示反应N2(g)+3H2(g)  2NH3(g); △H<0 在某一时间段反应速率与反应过程的曲线关系图,
2NH3(g); △H<0 在某一时间段反应速率与反应过程的曲线关系图,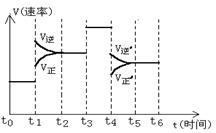
①达到平衡后,若只改变一个条件,则t1条件为 ;t3条件为 ;t4条件为 ;
②则图中氨的百分含量最低的时间段是:()
| A.t0-t1 | B.t2-t3 | C.t3-t4 | D.t5-t6 |
③请在右图中画出t6时刻既增加氢气浓度同时又减小氨气浓度的速率随时间的变化图。
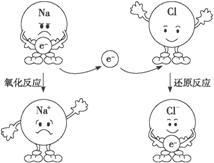
下图是以氯化钠为例表示的氧化反应、还原反应,以及氧化还原反应实质的示意图。认真分析示意图,总结归纳:什么是氧化反应?什么是还原反应 氧化还原反应的实质是什么?
______________

从以下图片中可以获取有关分散系的哪些知识 请谈谈你的看法。 
写出下列反应的离子方程式(每小题1分,共4分)
(1)铝与氢氧化钾浓溶液反应
(2)向偏铝酸钠溶液中通过量二氧化碳
(3)向NaHSO 4 溶液中加入Ba(OH)2 使溶液呈中性
(4)过氧化钠与稀食盐水反应