(4分)为定量研究长期放置氢氧化钠药品变质情况,化学兴趣小组的同学设计了如下实验,其主要实验步骤如下: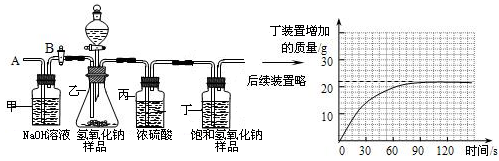
Ⅰ.按图组装仪器,将55.0g试样放入锥形瓶中,加入足量稀硫酸溶液;
Ⅱ.测量一定时间内装置丁内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量装置丁内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至装置丁内物质质量不变.
请根据实验数据,通过计算分析氢氧化钠变质情况(“全变质”,“部分变质”或“不变质”,要有详细的计算步骤,没有步骤不得分)
铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 |
1 |
2 |
3 |
4 |
| 加入稀硫酸质量/g |
50 |
50 |
50 |
50 |
| 剩余固体质量/g |
8.5 |
7 |
6.6 |
6.6 |
(1)铜镁合金中铜的质量。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
| 反应前 |
反应后 |
||||
| 实验数据 |
烧杯的质量/ | 稀盐酸的质量/ | 混合物样品的质量/ | 烧杯和其中混合物的质量/ | |
| 40.6 |
123.4 |
12 |
171.6 |
(1)反应生成二氧化碳的质量为g;
(2)样品碳酸钠的质量分数是多少?(最后结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?
向10
硫酸钠溶液中不断滴加氯化钡溶液,加入氯化钡溶液质量与生成沉淀的质量变化关系如图所示,完成以下问题:
(1)生成沉淀的质量是
;
(2)恰好完全反应时过滤,计算所得滤液中溶质的质量分数是多少?
重铬酸钾( ,铬元素为 价, 表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但 价格有很强的毒性易污染环境,使用后,须用绿矾,( )将其变成毒性 价格才能做后续处理.反应原理是: 现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
实验室用50g溶质质量分数为19.6%的稀硫酸与足量的锌粒充分反应,可以生成氢气多少克?