(5分)水是生命的源泉,爱护水、了解水的有关知识是很有必要的。
(1)自来水厂通常对天然水进行沉淀、过滤、吸附、 ,使之达到饮用水标准。在实验室里,若要得到净化程度最高的水,可用 的方法。
(2)饮用硬度过大的水都不利于人体健康,通常我们可用 检验硬水和软水,生活中常用 的方法使硬水软化。
(3)节约用水是每个公民的义务,以下方式中有利节水的是 (填字母序号)。
A.用淘米水、洗菜水浇花、冲厕所
B.加了过量洗衣粉洗衣服,然后反复冲洗
C.不间断地放水刷牙
(4分)按照要求写出下列化学方程式:
(1)实验室用氯酸钾制取氧气
(2)木炭粉与氧化铁发生化学反应
(3)铁在氧气中燃烧产生黑色固体
(4)碳酸在常温下发生分解反应
(2分)请用化学用语填写下列空白:
(1)3个氢氧根离子(2)5个二氧化氮分子
(3)2个氮原子(4)硫酸铜中铜元素的化合价
实验室制取气体的装置如下图所示,根据所学的知识回答下列问题。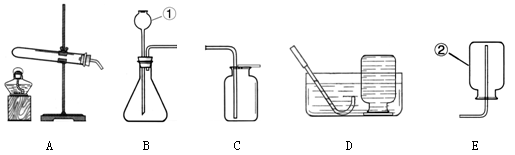
(1)图中仪器①名称为;
(2)写出实验室用装置B制氧气的化学方程式,制取气体时,组装好仪器后,应先,再添加药品;收集氧气时,使用(选填装置序号〕所示的方法收集到的气体比较纯净;
(3)某兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如下图。在干燥管内的铜网上应盛放的药品是,若将铜网换成铁网,可能产生的后果是,与装置B相比,该装置具有的优点是;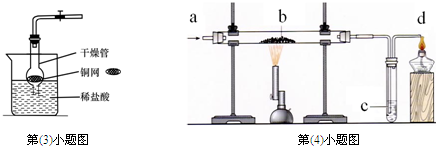
(4)某小组利用上图装置完成O2、 CO或CO2的有关实验, 实验过程中,他们从a处通入一种气体,在b处放入一种固体。C处放入一种溶液。
①若从a处通入O2,观察到b 处发出白光,c处的无色溶液变浑浊,则b处放置的黑色固体为,c处发生反应的化学方程式为;
②若b处固体由红色变为黑色,且反应后的固体可被磁铁吸引,c处紫色溶液变红。则b处发生反应的化学方程式为,d处酒精灯的作用是。
人类的生产、生活离不开金属。
(1)目前世界上年产量最高的金属是(填化学式) ;
(2)铁制品锈蚀,实际上是铁跟空气中的发生了化学反应。防止铁制栏杆锈蚀的一种方法是;
(3)已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4溶液
B.Mg和MnSO4溶液
C.Mn和FeSO4溶液
①写出Fe 和CuSO4溶液反应的化学方程式;
②Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序。
(4)工业生产中常用10%的稀盐酸来除去铁制品表面的铁锈,实验室若要配制该盐酸200g,则需要溶质的质量分数为38%的浓盐酸g(计算结果请保留至0.1g);实验室在配制10%的稀盐酸的过程中,除了用到烧杯、量筒和胶头滴管外,还需要用到的玻璃仪器是。
(5)某化学小组在实验结束后,进行了如下废液处理: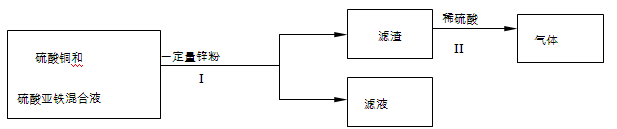
①Ⅰ中的操作名称是;
②写出Ⅱ中一定发生反应的化学方程式;
③滤液中溶质的组成可能是(写出一种情况即可)。
(8分)溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)厨房中的下列物质加入水中,能形成溶液的有(填编号);
a.面粉b.食盐c.白糖d.牛奶
(2)下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线。
①t2℃时,甲的溶解度(填“>”、“<”或“=”)乙的溶解度;
②t1℃时,将50克的甲加入到100克的水中,充分搅拌后所得溶液的质量为克;
③将t1℃时甲的饱和溶液升高温度到t2℃(假设水分没有蒸发),则与原溶液相比,所得溶液中溶质的质量分数将(填“变大”、“变小”或“不变”);
④将t2℃时,甲、乙两种物质相同质量的饱和溶液,分别冷却到t1℃,析出晶体最多的是物质。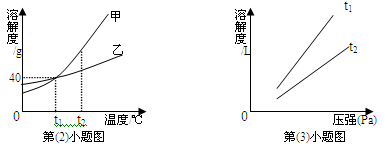
(3)气体的溶解度也有一定的变化规律。
①打开可乐瓶,逸出大量气泡。由此可见,压强越小,CO2的溶解度越。为增大CO2的溶解度,可采用的一种方法是。
②不同温度下,氧气的溶解度随压强的变化如上图所示,图中t1对应的温度为40℃,则t2对应的温度(填编号)。
a.大于40℃b.小于40℃c.无法确定