Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I实验原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
II实验装置:如图1所示,有关物质的溶解度曲线如图2所示: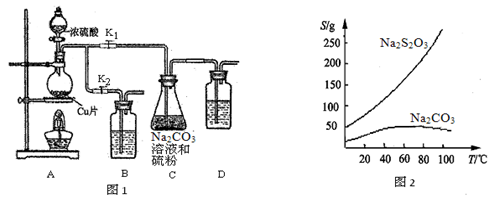
Ⅲ实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置 C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式: 。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过 、 、过滤、洗涤、烘干,可得粗产品Na2S2O3·5H2O。
IV产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯。测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10mL稀硫酸,准确量取流动水样100mL(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1mL淀粉溶液变蓝,则说明水样中有余氯。再以cmol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)按上述方案实验,消耗标准Na2S2O3溶液VmL,该次实验测得自来水样品中余氯量(以游离Cl2计算)
为 mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果 (填“偏高”、“偏低”或“不变”)。
(8分)为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
实验二:取上述实验后锥形瓶中清液,进行如下实验:
(1)该清液滴在有色布条上有极强的漂白作用。
(2)该清液中滴加碳酸钠溶液产生白色沉淀。
(3)该清液中滴加稀盐酸可产生大量气体。
(4)该清液加热后变浑浊并产生大量气体。
实验三:该学生设想用下列装置收集实验二中产生的气体作进一步检验。
回答下列问题:
(1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有(写化学式);清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有离子;清液加热后产生浑浊的原因是因为生成了(用化学式表示)。
(2)实验三中,洗气装置内的洗涤液一般用溶液。
(3)在反应物的量相同情况下,该学生尝试用集气装置A和集气装置B分别和洗气装置相连来收集气体。选用集气装置(选填“A”或“B”)可收集到更多的气体。经试验,该学生最终选用集气装置B进行下一步实验。其选择装置B的原因是
(4)该学生通过上述实验,写出了氯水和碳酸钙反应的化学方程式为
铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验步骤〗
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
【方案二】
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01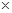 105Pa)的体积。
105Pa)的体积。
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验: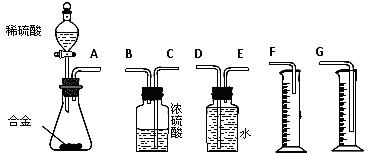
①你认为最简易的装置其连接顺序是:A接()()接()()接()(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是。
| A.待实验装置冷却后再读数 |
| B.上下移动量筒F,使其中液面与广口瓶中液面相平 |
| C.上下移动量筒G,使其中液面与广口瓶中液面相平 |
| D.视线与液体的凹面相平读取量筒中水的体积 |
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了下图所示的实验装置。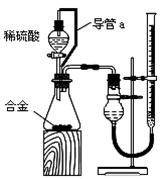
①装置中导管a的作用是
。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。
Ⅰ(本题9分)乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量。
| 乙酸乙酯 |
乙醇 |
乙酸 |
|
| 沸点 |
77.1℃ |
78.5℃ |
117.9℃ |
操作步骤如下:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/LNaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol/LNaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol/LHCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的(填a或b)管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口装配相关的仪器或操作是:(填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议
Ⅱ(本题6分)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50 mL溶液体积的容器是____________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将________(填“偏大”或“偏小”)。
在“部分酸碱盐溶解性表”中存在“碳酸亚铁”。某学习小组设计实验探究碳酸亚铁的性质。
(一)制备碳酸亚铁。
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体。
(1)写出离子方程式:。
(二)探究碳酸亚铁的热稳定性(加热仪器省略)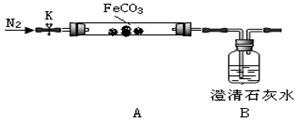
连接仪器、装药品。打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊。待固体分解完后,继续通入氮气至玻璃管冷却。
(2)先通入氮气的目的是。B瓶现象能说明。
(3)停止加热之前,是否拆开A、B之间橡胶管?答:;理由是。
(三)探究碳酸亚铁还原性
【查阅资料】①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁。②碳酸亚铁在空气中灼烧生成氧化铁。
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】假设1固体成分是氧化铁;
假设2固体成分是四氧化三铁;
假设3。
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管。Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却。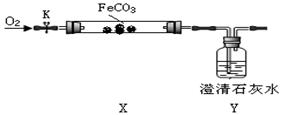
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解。将溶液分成甲、乙两份溶液,进行后续实验。
| 实验编号 |
实验步骤 |
实验现象 |
| i |
向甲溶液滴加KSCN溶液 |
溶液变红色 |
| ii |
向乙溶液滴加酸性高锰酸钾溶液 |
溶液不褪色 |
【实验评价】上述实验(填:i或ii)不能确定样品成分。
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是。
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g。通过计算确定固体成分是。
工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。
NH3+CO2+H2O+NaCl(饱和)= NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.制取碳酸氢钠晶体可供选用的药品有:a.石灰石 b.生石灰 c.6mol/L盐酸 d.稀硫酸
e.浓氨水 f.饱和氯化钠溶液。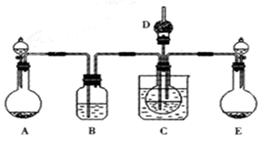
①A中制备气体时,所需药品是(选填字母代号);
①B中盛有饱和碳酸氢钠溶液,其作用是;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为;
④E装置向C中通气的导管不能插入液面下的原因是。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图所示实验:
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号);
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为、、;
③所得晶体中碳酸氢钠的纯度为。