X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式 .
(3)甲与氯化氢反应生成乙.乙所含化学键类型有 .在0.1mol•L﹣1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)工业上,可通过如下转化制得尿素晶体:
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是 。
②反应Ⅱ:2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(i)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
已知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式 。
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸 发生化反应的产物。
发生化反应的产物。
(1)甲一定含有的官能团的名称是_____________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是_____________________________。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)___________________。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)____________。
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液d.Na
②丙的结构简式是_________________,反应Ⅱ的反应类型是___________。
③反应Ⅳ的化学方程式是
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+Fe2++H+=Mn2++Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为g。
(4)混合物中Cu2S的质量分数为。
(1)用5.0 mol·L-1的NaOH溶液配制0.1mol·L-1的NaOH溶液时,下图所示的仪器中,肯定不需要的是________(填序号),配制上述溶液还需要的玻璃仪器是________________________________________________(填仪器名称).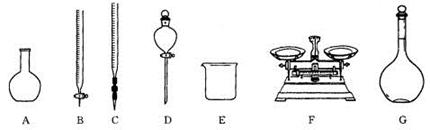
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)________.
①准确取出的浓NaOH溶液在空气中露置时间过长;②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;④稀释NaOH溶液的仪器未洗涤.
某温度时,在2 L容器中X、Y、Z三种物质随时间的变化曲线如图所示: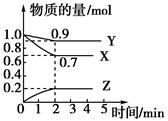
(1)由图中的数据分析,该反应的化学方程式为__________________________。
(2)反应开始至2 min时Z的平均反应速率为____________。