(1) 氨催化氧化法是工业制硝酸的主要方法,可进行连续生产。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式_____________________________。
(2) 恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①写出合成氨反应N2(g)+3H2(g) 2NH3(g)的平衡常数表达式:__________________________
2NH3(g)的平衡常数表达式:__________________________
②上表中K1_______K2(填“>”、“=”或“<”)。
(3) 如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图。
①下列说法正确的是__________(填序号)。
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2) =3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为 。
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式 。
(5)25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )。
A.25 ℃时,饱和Mg(OH)2溶液中c(OH—)大于饱和MgF2溶液中c(F—)
B.25 ℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.056 1 mol·L-1,则溶液的pH=9
C.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式):。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为、。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为,每个K+与个F-配位。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是,原因是。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:。
| 电离能/(kJ·mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有个σ键,个π键,其中心原子采取杂化轨道方式。
,每个COCl2分子内含有个σ键,个π键,其中心原子采取杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是。
下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:。
元素C、D、E、F的第一电离能由大到小的顺序是(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为。
②该化合物的晶体中存在的作用力有。
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是。
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为,含有离子键、等化学键。
(2)生成物中含有10个电子的分子是(写分子式),该分子的空间构型为,中心原子的杂化方式为。
(3)反应物中电负性最大的元素为(填元素符号),写出其原子最外层的电子排布图:。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为;Al晶体的密度为(用字母表示)。
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、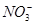 、
、 、Cl-、I-、
、Cl-、I-、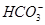 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 |
溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有,溶液中肯定存在的离子是。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)。