已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g) △H= -283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H= -241.8kJ/mol
据此判断下列说法正确的是
| A.H2(g)+1/2O2(g)=H2O(l) △H>-241.8kJ/mol |
| B.H2(g)的燃烧热△H ="-241.8" kJ/mol |
| C.H2(g)转变成H2O(g)的化学反应一定放出能量 |
| D.CO(g)+ H2O(g)= CO2(g)+ H2(g)的△H =-41.2kJ/mol |
下列事实不能用勒夏特列原理解释的是()
| A.氨水应密闭保存,置低温处 |
| B.在FeCl2溶液中加入铁粉防止氧化变质 |
| C.生产硝酸中使用过量空气以提高氨的利用率 |
| D.实验室用排饱和食盐水法收集氯气 |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是()
。恒容时,温度升高,H2浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1)⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是()
| A.⊿H1>⊿H2>⊿H3 | B.⊿H1<⊿H3<⊿H2 |
| C.⊿H1<⊿H2<⊿H3 | D.⊿H1>⊿H3>⊿H2 |
白磷与氧可发生如下反应:P4+5O2="==" P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是( )
H,其中正确的是( )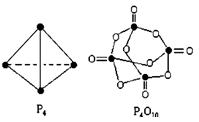
| A.(6a+5d-4c-12b) kJ·mol-1 |
| B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 |
| D.(4a+5d-4c-12b) kJ·mol-1 |
.已知在一定条件下有CO(g)+H2O(g)  CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
| A.反应放出的热量为0.04a KJ |
| B.平衡时H2O的转化率为40% |
| C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动 |
| D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |