(14分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。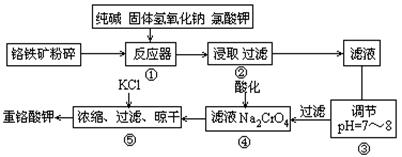
(1)碱浸前将铬铁矿粉碎作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
某化学兴趣小组的同学对实验室乙酸乙酯的制取和分离进行了实验探究。
【制备】下列是该小组同学设计的实验装置。回答下列问题:
(1)仪器A的名称▲,装置中长导管的主要作用是▲;
(2)证明锥形瓶中收集到乙酸乙酯的简单方法是▲;
【分离】锥形瓶中得到的产物是混合物,为了分离该混合物,设计了如下流程:
(3)a试剂最好选用▲;
(4)操作Ⅰ、操作Ⅱ分别是▲
| A.过滤、分液 | B.萃取、蒸馏 | C.分液、蒸馏 | D.过滤、蒸发 |
【讨论】研究表明质子酸离子液体也可用作酯化反应的催化剂。通过对比实验可以研究不同催化剂的催化效率,实验中除了需控制反应物乙酸、乙醇的用量相同外,还需控制的实验条件是▲。
某同学在学习乙醇的知识后,设计了如下的实验。操作步骤为:
①在试管里加入2 mL 乙醇;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有乙醇的试管里(如图),反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
试回答下列问题:
⑴该实验的目的是;
⑵第④步操作中,能闻到气味;
⑶写出反应的化学方程式。
控制反应条件可改变化学反应速率。
(1)使用催化剂是改变化学反应速率的一种方法,例如H2O2在MnO2作用下分解,请写出该反应的化学方程式:_____________________________。
(2)经研究发现Fe3+和Cu2+对H2O2的分解也具有催化作用。
某研究小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验,请将他们的实验方案补充完整:
实验目的:_________________________________-
实验试剂:5%H2O2溶液,0.1mol/LFeCl3溶液,0.1mol/LCuSO4溶液
实验仪器:试管、胶头滴管
实验步骤:取两支试管各加入1mL5%H2O2溶液,分别滴加两滴0.1mol/LFeCl3溶液、0.1mol/LCuSO4溶液。
该小组的同学可通过观察______________________以比较出Cu2+和Fe3+的催化效果。
问题与讨论:有同学提出将FeCl3改为Fe2(SO4)3更合理,你认为他的理由是____________________________________________________。
(3)影响化学反应速率的因素除催化剂外,还有______________(答出一种即可),并举一例生产、生活实例加以说明:__________________________。
人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提 取碘的流程和实验装置如下:
取碘的流程和实验装置如下: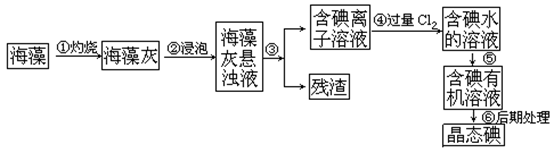
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③______,步骤⑤______。
(2)写出步骤④对应反应的离子方程式:______________________________。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是_________________________________________________________。
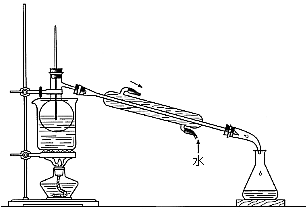
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。
。
|
实验室制取气体常用的装置如下列图示,请回答下列问题:(选用装置时填字母编号)

 ______________________,
______________________,
 满的方法:____________________________________________________;
满的方法:____________________________________________________;