NA表示阿伏加德罗常数,下列叙述正确的是
| A.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g |
| B.1 mol Na2O2固体中含离子总数为4NA |
| C.1mol羟基与17 g NH3所含电子数之比为9:10 |
| D.一定温度下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH的物质的量相同 |
下列物质的转化在给定条件下能实现的是
①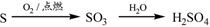
②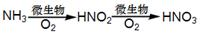
③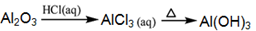
④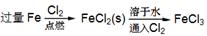
⑤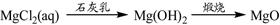
| A.②③⑤ | B.①④⑤ | C.③④⑤ | D.①③⑤ |
下列解释实验现象的反应方程式正确的是
| A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O |
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72—+H2O 2CrO42—+2H+ 2CrO42—+2H+ |
| C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3 2Al+Fe2O3 |
若NA表示阿伏加德罗常数,下列说法正确的是
| A.Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 |
| B.常温常压下,92 g NO2和N2O4的混合气体中含有的分子数目为2NA |
| C.一定条件下,密闭容器充入1molN2和3molH2充分反应,转移电子的数目为6NA |
| D.FeCl3溶液中,若Fe3+数目为NA,则Cl—数目大于3NA |
下列说法正确的是
| A.实验室常用铝盐溶液与氢氧化钠溶液制备Al(OH)3沉淀 |
| B.将Na投入到NH4Cl溶液中只能生成一种气体 |
| C.过量的铜与浓硝酸反应有一氧化氮生成 |
| D.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH改变 |
下列说法正确的是
A. 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 |
B.化合物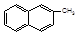 不是苯的同系物 不是苯的同系物 |
C. 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 |
| D.除甲酸外的羧酸均不能使酸性高锰酸钾溶液褪色 |