阿伏加德罗常数用NA表示,下列叙述正确的是
①22g T2O含有电子数为10 NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1 mol Na2O2与CO2完全反应时转移电子数为2NA
④28 g 硅晶体中含有2 NA个Si—Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200 mL,1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3 NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4 NA
| A.①②③⑤⑧ | B.②④⑥⑦⑧ | C.①③⑤⑥⑦ | D.①②④⑧ |
下列叙述正确的是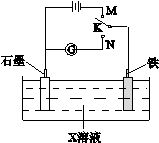
| A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 |
| B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e—=H2↑ |
| C.K与M连接时,X为硫酸,一段时间后溶液的pH增大 |
| D.K与M连接时,X为氯化钠,石墨电极反应:4OH—-4e—=2H2O+O2↑ |
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙。过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论不正确的是
| A.铜与浓硫酸反应所得白色固体甲是CuSO4 |
| B.加BaCl2溶液后所得白色沉淀是BaSO3 |
| C.白色固体甲中夹杂的少量黑色物质乙中可能含有CuO |
| D.白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |
下列说法正确的是
| A.用量筒量取硝酸的体积时,俯视读数偏大 |
| B.海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C.检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,加亚硝酸钠、AgNO3溶液和稀硝酸 |
| D.金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中 |
根据已知条件,对物质的性质强弱判断不正确的是
| A.已知HF的共价键键能比HCl大,说明稳定性:HF>HCl |
| B.已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 |
C.已知 +SO2+H2O→ +SO2+H2O→ +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 |
D.已知CaCO3+SiO2 CaSiO3+CO2↑,说明非金属性:碳>硅 CaSiO3+CO2↑,说明非金属性:碳>硅 |
下列反应的离子方程式书写不正确的是
| A.小苏打溶液显碱性:HCO3-+H2O≒H2CO3+OH- |
| B.FeCl3溶液中滴加过量的氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ |
| C.CuSO4溶液中滴加过量的氨水:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O |
| D.向FeSO4溶液中加少量过氧化钠粉末:6H2O+4Na2O2+4Fe2+=4Fe(OH)3↓+O2↑+8Na+ |