有A、B、E、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.D﹥A﹥B﹥E B.A﹥B﹥D﹥E
C.D﹥E﹥A﹥B D.A﹥B﹥E﹥D
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g),H<0,下列叙述正确的是( )
2Z(g),H<0,下列叙述正确的是( )
| A.平衡常数K值越大,X的转化率越大 |
| B.达到平衡时,反应速率:v正(X) = 2v逆(Z) |
| C.达到平衡后,降低温度,正反应速率减小的倍数小于逆反应减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该平衡向逆反应方向移动 |
下列事实能说明影响化学反应速率的决定因素是反应物本身性质的是( )
| A.Cu能与浓硝酸反应,而不能与浓盐酸反应 |
| B.Cu与浓硝酸反应比与稀硝酸反应快 |
| C.N2与O2在常温常压下不能反应,放电时可反应 |
| D.Cu与浓硫酸能反应,而与稀硫酸不反应 |
将H2(g)和I2(g)充入恒容密闭容器中,恒温下发生反应:H2(g)+I2(g) 2HI(g) ,H<0,平衡时,I2(g)的转化率为a;若初始条件相同,绝热下发生上述反应,平衡时,I2(g)的转化率为b。则a与b的关系是( )
2HI(g) ,H<0,平衡时,I2(g)的转化率为a;若初始条件相同,绝热下发生上述反应,平衡时,I2(g)的转化率为b。则a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
下列离子方程式中,属于水解反应的是( )
A.CH3COOH +H2O  CH3COO-+H3O+ CH3COO-+H3O+ |
B.SO2+H2O  HSO3-+H+ HSO3-+H+ |
C.HS-+H2O  S2-+H3O+ S2-+H3O+ |
D.CO32-+H2O  HCO3-+OH- HCO3-+OH- |
已知反应:CO(g)  C(s)+
C(s)+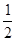 O2(g)的H为正值,△S为负值。设H和△S不随温度而变化,下列说法中正确的是( )
O2(g)的H为正值,△S为负值。设H和△S不随温度而变化,下列说法中正确的是( )
| A.低温下是自发变化 | B.高温下是自发变化 |
| C.低温下是非自发变化,高温下是自发变化 | D.任何温度下都是非自发变化 |