短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
(1)T的原子结构示意图为 。
(2)元素的非金属性(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
现有下列可逆反应:A(g)+B(g)  xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
请根据图像回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性(与反应体系中任一物质均不反应)气体后的情况,则曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是热反应(填“吸”或“放”);
(4)化学计量数x的值(填取值范围);判断的依据是。
合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2CH3COO]+CO+NH3 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)
[Cu(NH3)3]CH3COO·CO(正反应为放热反应)
(1)必须除去原料气中的CO的原因是。
(2)醋酸二氨合铜(Ⅰ)溶液吸收CO的生产适宜条件是。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨溶液再生的适宜条件是。
在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化示意图如下: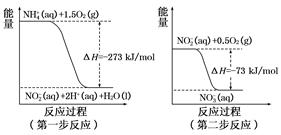
(1)第二步反应是反应(选填“放热”或“吸热”),判断依据是。
(2)1 mol NH4+ (aq)全部氧化成NO2- (aq)的热化学方程式是。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题: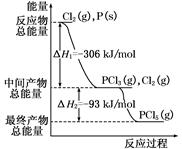
(1)P和Cl2反应生成PCl3的热化学方程式是;
(2)P和Cl2分两步反应生成1 mol PCl5的ΔH3=,P和Cl2一步反应生成1 mol PCl5的ΔH4ΔH3(填“大于”、“小于”、或“等于”)。
已知下列热化学方程式:
①H2(g)+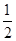 O2(g)=H2O(l)ΔH=-285.8 kJ/mol
O2(g)=H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+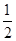 O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+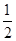 O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是。
(2)H2的燃烧热为,C的燃烧热为。
(3)燃烧10 g H2生成液态水,放出的热量为。
(4)CO的燃烧热为,其热化学方程式为。