中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B (g)  C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min |
n(A)/mol |
n(B)/ mol |
| 0 |
1.00 |
1.20 |
| 10 |
0.50 |
|
| 30 |
0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 |
无银镜生成 |
淀粉未发生水解 |
| B |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或HCO3- |
| C |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D |
取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 |
溶液变为血红色 |
绿矾部分或全部被氧化 |
硝苯地平是第一代钙拮抗剂,为抗高血压、防治心绞痛药物,结构如图所示。下列说法中错误的是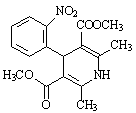
| A.该物质的分子式为C17H18N2O6 |
| B.该物质能使酸性KMnO4溶液褪色 |
| C.1 mol该物质最多能与6 molH2发生加成反应 |
| D.一定条件下,该物质既能与盐酸反应、又能与NaOH溶液反应 |
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是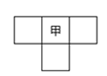
| A.元素甲的简单气态氢化物稳定性比乙的强 |
| B.元素丁在周期表中的位置为第3周期,VIA族 |
| C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
| D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |