利用如下图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
| A |
稀硫酸 |
Na2CO3 |
Na2SiO3溶液 |
非金属性:S>C>Si |
| B |
稀硝酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
| C |
浓盐酸 |
MnO2 |
NaOH溶液 |
氧化性:MnO2 >Cl2 |
| D |
浓硫酸 |
蔗糖 |
酸性KMnO4溶液 |
浓硫酸具有酸性、脱水性 |
下列各项表述与示意图一致的是: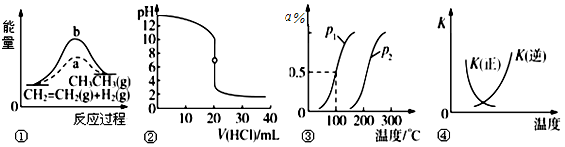
| A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化 |
| B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
C.图③表示CH4(g)+H2O(g)  CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0 CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0 |
D.图④ 中曲线表示反应2SO2(g)+O2(g)  2SO3(g) ΔH<0;正、逆反应的平衡常数K随温度的变化 2SO3(g) ΔH<0;正、逆反应的平衡常数K随温度的变化 |
根据下图海水综合利用的工业流程图,判断下列说法正确的是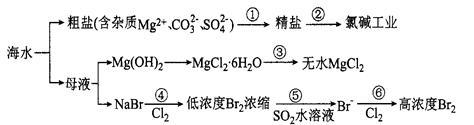
已知:MgCl2.6H2O受热生成Mg(OH) Cl和HC1气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
| C.在过程④、⑥反应中每氧化0.2 mol Br一需消耗2.24LCl2 |
| D.在过程③中将MgCl2.6H2O灼烧即可制得无水MgCl2 |
某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是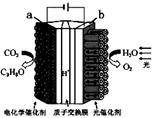
| A.该装置将化学能转化为光能和电能 |
| B.该装置工作时,H+从a极区向b极区迁移 |
| C.每生成1 mol O2,有44 g CO2被还原 |
| D.a电极的反应为:3CO2+ 18H++18e-=C3H8O+5H2O |
某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:
则下列说法正确的是
| A.气体甲、沉淀甲一定为纯净物 |
| B.CO32-、Al3+、K+一定不存在 |
| C.SO42-、NH4+一定存在,NO3-、Cl–可能不存在 |
| D.若含有Fe3+,则一定含有Cl- |
下列离子方程式正确的是:
| A.向NaClO溶液中通入少量SO22ClO-+SO2+H2O=2HClO+SO32- |
| B.向Fe2(SO4)3溶液中通入足量的H2S Fe3++H2S=Fe2++S↓+2H+ |
| C.向FeBr2中通入等量Cl22Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D.Fe(OH)3和HI的反应 Fe(OH)3+3H+=Fe3++3H2O |