PM2.5污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX。
(1)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量,写出该反应的热化学方程式 。若起始时向密闭容器内充入0.4molSO2和0.2mol O2,达平衡后放出的热量为Q,则Q 39.32kJ(填“>”、“<”或“=”).
(2)一定条件下,在恒容密闭的容器中,当上述反应达到平衡时,下列说法正确的是__________(填序号)
a.2v逆(SO2)=v正(O2)
b.ΔH保持不变
c.混合气体密度保持不变
d.混合气体的平均相对分子质量保持不变
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和1 mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同,),充分反应均达到平衡后,两容器中SO2的转化率关系是I_________II(填“>”、“<”或“=”)。若测得容器II中的压强减小了30%,则该容器中SO3体积分数为 (结果保留3位有效数字)。
(4)将生成的SO3溶于水,再向溶液中通入NH3得到1L cmol/L(NH4)2SO4溶液的PH=5,计算该(NH4)2SO4溶液的水解平衡常数Kh= 。
(5)NO2、O2和熔融NaNO3可制作原电池,其装置见下图。该电池中Na+向 _____电极移动(填“Ⅰ”或“Ⅱ”),在电池使用过程中石墨I电极上生成氧化物Y,其电极反应为 。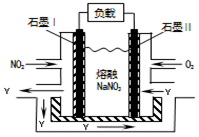
在一定体积的密闭容器中,进行反应CO2(g)+ H2(g)  CO(g)+ H2O(g)。其平衡常数K和温度T的关系如表所示:
CO(g)+ H2O(g)。其平衡常数K和温度T的关系如表所示:
| T/℃ |
70 0 0 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________________
(2)该反应为______反应(填“吸热”或“放热”)
(3)能判断该反应达化学平衡状态的依据是____
A:容器中压强不变 B:混合气体中C(CO)不变
C:V(H2)正=V(H2O)逆D:C(CO2)=C(CO)
(4)某温度下,平衡浓度符合下式:C(CO2) ·C(H2)=" C(CO)" ·C(H2O)试判断此时的温度__________________
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为C(CO2) 为2 mol/L ,C(H2)为1.5 mol/L ,C(CO) 为1mol/L, C(H2O)为3 mol/L,则此时刻反应向____(填“正向”或“逆向”)进行
在室温下,下列五种溶液①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③ 0.1mol/ L NH4HSO4④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液⑤0.1mol/LNH
0.1mol/ L NH4HSO4④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液⑤0.1mol/LNH 3·H2O
3·H2O
(1)溶液①呈___性(填“酸”“碱”或“中”)其原因是____________________________(用离子方程式表示)
(2 )比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
)比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
(3)在溶液④中,_____________离子的浓度为0.1mol/L
NH3·H2O和_________离子的物质的量浓度之和为0.2mol/L
(4) 室温下测得溶液②的PH=7,则说明CH3COO-的水解程度_______(填>,<或=")" NH4+的水解程度,C(CH3COO-)_________C(NH4+)(填>,<或=)
(1)5.7g汽油(主要成分为C8H18,相对分子质量为114)完全燃烧生成液态水和CO2,放出275.9KJ的热量,则汽油的燃烧热为_______________
(2)已知:2H2(g)+ O2(g)=2H2O(g)△H="-483.6" KJ/mol
H2O(l)= H2O(g)△H="+44" KJ/mol
a):写出H2与O2反应生成液态水时的热化学方程式_________________________________
b):在通常情况下,若要得到857.4KJ的热量,需H2的质量为____,这些H2在标况下的体积为______.
X、Y、Z三种物质有如下的所示关系;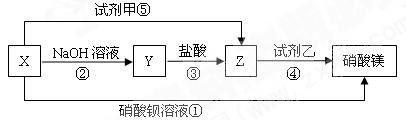
(1)根据上述转化关系,推断下列物质的化学式:
X,Y,Z,试剂甲,试剂乙。
(2)写出上述①~⑤步反应的离子方程式:
①;②;
③ ;④;
;④;
⑤。
在标准状况下,①6.72LCH4气体②2.408×1023个HCl气体分子③17gH2S气体④0.2molNH3,则下列比值为:
⑴标准状况下四种气体的体积比;
⑵四种气体的质量比;
⑶四种气体所含原子个数比。