【化学选修3:物质结构与性质】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外L层电子数是K层的2倍 |
| B |
其一种单质被称为地球生物的“保护伞” |
| C |
元素的第一电离能是第3周期所有元素中最小的 |
| D |
基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E |
可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第 周期、第 族;D的基态原子核外电子排布式是 。
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) ,B、D的简单氢化物中稳定性较大的是 。
(3)B的常见单质和C的单质按物质的量比1∶2反应生成的化合物中化学键的类型为 ;该化合物属于 晶体。
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 。
(5)已知:2AB(g)+B2(g) 2AB2(g) ΔH="-566.0" kJ·mol-1
2AB2(g) ΔH="-566.0" kJ·mol-1
D(s)+B2(g) DB2(g)ΔH="-296.0" kJ·mol-1
DB2(g)ΔH="-296.0" kJ·mol-1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: 。
在一定温度下,有1mol N2和3mol H2发生下列反应:
N2(g)+3H2(g) 2NH3(g)△H<0。
2NH3(g)△H<0。
(1)若在相同温度下,分别在1L定压密闭容器A中和1L定容密闭容器B中反应:达到平衡所需的时间t(A)t(B)(填“大于”“小于”或“等于”,下同)。平衡时是N2的转化率α(A)α(B)。
(2)若在上述定压密闭容器A中,反应已达到平衡时,再加入0.5 mol氩气,则N2的转化率如何变化(填“增大”“减小”“不变”,下同)。正反应速度与原平衡相比,有无变化,并简要说明理由。
按要求书写下列热化学方程式
(1)N2(g)和H2(g)反应生成1molNH3(g)放出46.1KJ热量
(2)航天领域使用氢氧燃烧电池有酸式和碱式两种,它们放电时的总反应可以表示为2H2 + O2 =2H2O,酸式氢氧燃烧电池的电解池是酸。其负极反应可以表示为2H2-4e-=4H+,则其正极反应可以表示为;;碱式氢氧燃烧电池的电解质是碱,其正极反应可以表示为:O2+2H2O+4e-=4OH-,则其负极反应可以表示为:。
(3)用石墨作电极电解NaCl水溶液
阳极的电极反应,阴极的电极反应
(4)在粗铜精炼的反应中
当阳极,发生(填“氧化”或“还原”)反应,
阳极的电极反应
(5)将H+、Cu2+、SO42-、Cl-五种离子组成电解质按要求进行电解:以碳棒为电极,使电解质质量减少,水量不变进行电解,应采用的电解质是、;
F是新型降压药替米沙坦的中间体,可由下列路线合成: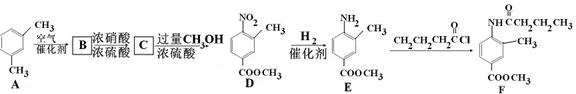
(1)反应类型: D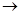 E:___ _,E
E:___ _,E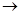 F:____。
F:____。
(2)写出满足下列条件的B的所有同分异构体 __________ (写结构简式)。
①含有苯环②含有酯基③能与新制Cu(OH)2反应
(3)C中含有的官能团名称是 ________________________。已知固体C在加热条件下可溶于甲醇,下列C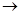 D的有关说法正确的是。
D的有关说法正确的是。
a、D的化学式为C9H9NO4
b、浓硫酸的吸水性可能会导致溶液变黑
c、甲醇既是反应物,又是溶剂
(4)E的同分异构苯丙氨酸经缩聚反应形成的高聚物是 ____(写结构简式)。
(5)F在强酸和长时间加热条件下发生水解反应的化学方程式是 _____。
已知有机物A分子中有3个碳原子,有关它的某些信息注明在下面的示意图中: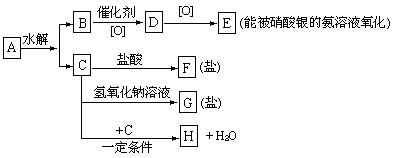
(1 )A、F、G的结构简式为:___________,____________,______________.
(2) 生成H的化学方程式为:__________________________________.
某学生取18g淀粉溶于水,为测定淀粉的水解百分率,其程序如图: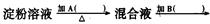
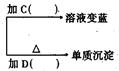
(1)各步所加试剂为:A、B、C、D。
(2)只加A溶液而不加B溶液是否可以,理由。
(3)当析出2.16g沉淀时,淀粉水解率为。