草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为: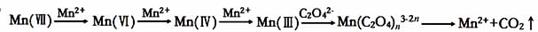
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间(s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
|
18 |
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x = ,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为 。上述实验中KMnO4溶液的物质的量浓度为 。
实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:
(1)NaHCO3受热分解的化学方程式是。
(2)加热一段时间后,观察到烧杯中有,
(3)实验结束时为防止倒吸,正确操作是。
①先将导管从液 体中移出,再熄灭酒精灯
体中移出,再熄灭酒精灯
②先熄灭酒精灯,再将导管从液体中移出
铁、铝的混合物进行如下实验: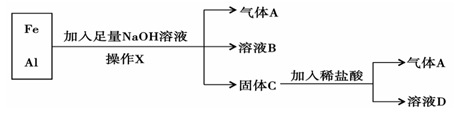
(1)操作X的名称是。(2)气体A是(填化学式)。
(3)A与Cl2混合光照可能发生爆炸,生成(填化学式),A在该反应中作为
(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有(填化学式),溶液D中存在的金属离子为(填化学式)。
为了达到下 表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。
表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。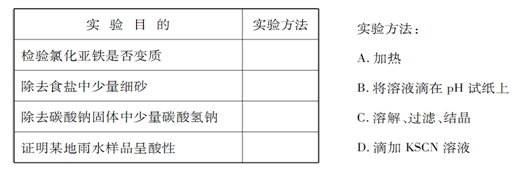
某研究性学习小组为测定,13.7g某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用下图所示的仪器装置进行实验(②装置未画全)。试回答有关问题:
(1)请选择适当的仪器,连接装置的正确顺序是_。
(2)加热时NaHC03分解的化学方程式为。
(3)完成该实验尚缺的玻璃仪器是(填名称);产生气体从装置④的进入,从装置⑤的进入(填接口序号)。
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积。
(4)加热后的固体与足量盐酸反应的离子方程式为。
数据分析及结论:
(5)加入盐酸至无气体产生时,生成CO2体积在标准状况时为2.24L,则Na2CO3样品的纯度为。
误差分析:
(6)有同学认为实验一⑤中用水会使测量结果产生误差,你认为原因可能是。
(7)有同学发现在实验—读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值(填“偏大”、“偏小”或“无影响”)。
某些化学反应可表示为:A+B=C+D十H2O(未配平,条件略)。请回答:
(1)若A为主族元素,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色。请写出A与B的稀溶液反应的化学方程。
(2)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式。
(3)若A为黑色固体,C是黄绿色的单质气体。当产生标准状况下33.6LC气体时,参加反应的A的质量为。
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物。则: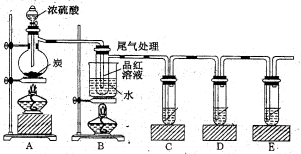
若证明有水生成,需要在.A、B之间加装盛有的干燥管。若证明生成CO2,需要C试管盛放(填化学式)溶液。装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象;该实验的尾气可采用NaOH溶液吸收,有关反应离子方程式为。