(原创)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)  NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
则反应a的平衡常数表达式为_______;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc |
D.d点: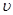 (正)> (正)> 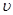 (逆) (逆) |
(3)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_________________________________ (任写一种)。
向100 ml浓硫酸中加入64 g铜片,加热一段时间后,至不再反应为止,请回答下列问题:
(1)写出反应的化学方程式:。
(2)若反应中有1.5 mol电子转移,被还原的硫酸为mol,标准状况下生成的SO2气体体积为L。
(3)将(2)反应后液体过滤,加水稀释滤液至500 ml,加足量Zn粉,经足够长的时间后,放出标准状况下6.72L H2,则反应的Zn的质量为g,原浓硫酸的物质的量浓度为mol·L-1。
某硫酸厂以硫铁矿为原料生产硫酸,主要过程的化学反应情况如下:
| 生产过程 |
化学反应 |
反应情况 |
| 硫铁矿的燃烧 |
4+11O2 2Fe2O3+8SO2 2Fe2O3+8SO2 |
4%的硫元素损失而混入炉渣 |
| SO2的接触氧化 |
2SO2+O2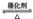 2SO3 2SO3 |
SO2转化率为95% |
| SO3的吸收 |
SO3+H2O=H2SO4 |
SO3的吸收率为98% |
(1)将硫铁矿燃烧的化学方程式补充完整:4+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)该厂现用100吨含硫40%的硫铁矿生产硫酸,可生产98%的浓H2SO4多少吨?(除上述硫的损失外,忽略其它损失)
甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体,丁为黄色固体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:



(1)按要求写出下列物质的化学式:
乙:B:
(2)写出溶液C与氯水反应的离子方程式:
(3)在催化剂和加热条件下,A可与丙反应,化学方程式为:
下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为
(2)若A为有臭鸡蛋气味的气体,C为H2SO3的酸酐,则B为:,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为
氯水中存在的分子有:和H2O,离子有:和极微量的OH-,向其中滴加几滴石蕊,溶液先变红,后褪色的原因是: