选做[化学—物质结构与性质]氨是重要的化工原料,用途很广。
(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+ 和CH3COO-构成)溶液吸收对氨合成催化剂有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是 (填元素名称)。
②醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 (填标号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 种(不含Cu)。
(2)BF3气体与NH3相遇立即生成一种白色晶体:BF3 + NH3= F3B—NH3。
①BF3和NH3分子的空间构型分别为 、 。
②晶体F3B—NH3中,B原子的杂化轨道类型为 。
(3)NH3可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。该物质易溶于水,在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在。N4H44+遇碱生成一种形似白磷的N4分子。
①下列相关说法中,正确的是 (填序号)。
a.N4是N2的同分异构体
b.1mol N4分解生成N2,形成了4mol π键
c.白磷的沸点比N4高,原因是P—P键键能比N—N键大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
②画出N4H44+的结构(标明其中的配位键): 。
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A: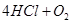
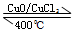
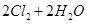
已知:i.反应A中,2mol 电子发生转移,放出57.8kJ的热量。
ii.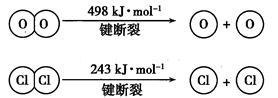
①H2O的电子式是 。
②反应A的热化学方程式是 。
③断开1mol H-O键与断开1mol H-Cl键所需能量相差 kJ,H2O中H-O键比HCl中H-Cl键 (填“强”或“弱”)
下列物质中属于强电解质的是: ,属于弱电解质的是 。
a.BaSO4
b.NaHCO3
c.H2SO3
d.Cu
e.Fe(OH)3
写出c、e两物质的电离方程式 。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。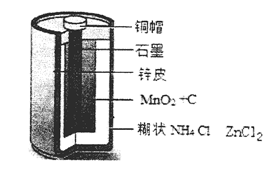
(1)该电池的负极材料是 电池工作时,电子从Zn极流向 填(“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
欲除去Cu2+,最好选用下列试剂中的 (填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液制取,则MnO2在 极产生。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。(MnO2的摩尔质量为:87g/mol)
回答下列问题。
(1)如右图,某温度(t℃)时水的图像如下,a点离子积KW=__________mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显_________性。
(2)25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH__________,NH+4的物质的量浓度________。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显______(填“酸性”、“碱性”、“中性”),则混合前c(NaOH)___________C(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5mol·L-1),则溶液的pH最小为___________。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶液浸取过程中会发生反应:
CaSO4(s)+CO2-3(aq)  CaCO3(s)+SO2-4(aq)。
CaCO3(s)+SO2-4(aq)。
已知298K时,KSP(CaCO3)=2.80×10-9, KSP(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_________(计算结果保留三位有效数字)。
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数这比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_________、_________;杂化轨道分别是__________、_________;a分子的立体结构是___________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体,_________晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________。
(4)Y与Z比较,电负性较大的_________,
(5)W元素的化学式__________,其+2价离子的核外电子排布式是___________。