(15分)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成CO,充分燃烧时生成CO2,反应放出的能量如图1所示
(1)在通常状况下, 更稳定(填“金刚石”或“石墨”),金刚石转化为石墨的热化学方程式为 。
(2)CO、O2和熔融Na2CO3可制作燃料电池,其原理见图2。石墨Ⅰ上电极反应式为 。
(3)用CO2生产甲醇燃料的方法为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
①下列时间段平均反应速率最大的是 。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
②仅改变某一个实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变,再充入3molCO2和4molH2,H2O(g)的体积分数 (填“增大”“减小”或“不变”)。
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,过滤后再重结晶得草酸晶体。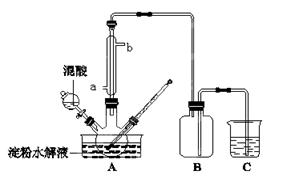
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是:。
(2)冷凝水从a口进入,但实验中若混酸滴加过快,将导致草酸产量下降,其原因是。
(3)检验淀粉是否水解完全所用的试剂为。
(4) 当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为:。
(5) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为。
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还可防止环境污染。现按下列方式进行综合利用: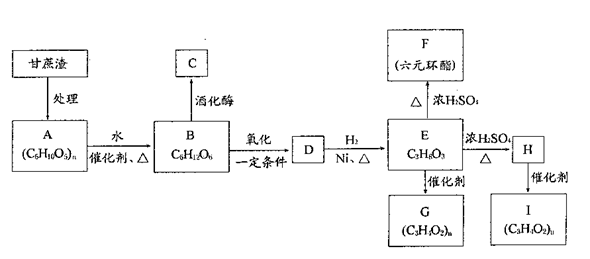
按要求完成问题:
(1)C的官能团名称:,D的结构简式:;
(2)写出化学方程式(有机物用结构简式表示):E→F:,H→I;
(3)写出下列转化的反应类型:E→G:,E→H:;
(4)已知X是B的同分异构体,且满足下列三个条件:
①X为六元环状化合物,含有母体:
②X的母体: 上四个碳原子各连接1个支链或取代基。
上四个碳原子各连接1个支链或取代基。
③l mol X与足量的金属钠反应放出2molH2。
则符合上述条件的X的结构简式共有种(选填A、B、C、D)。
A.3 B.4 C.5 D.6
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物。已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1;18.0 g水蒸气液化时的能量变化为44.0 kJ。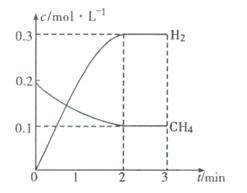
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式。
(2)在一定条件下,向体积固定为2 L的密闭容器中充人0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示。3 min时改变条件,反应进行到4 min时,体系中各物质的物质的量如下表所示:
| t/min |
n(CH4)/mol |
n(H2O)/mol |
n(CO)/mol |
n(H2)/mo1 |
| 4 |
0.18 |
0.38 |
0.22 |
0.66 |
则3~4min之间,平衡向(填“正”或“逆”)反应方向移动,3min时改变的条件是。
(3)已知温度、压强和碳水比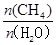 对该反应的影响如图所示。
对该反应的影响如图所示。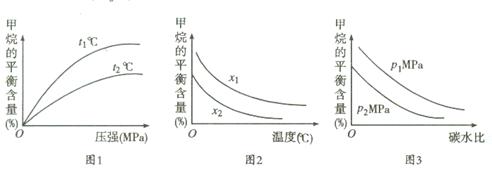
①图1中,两条曲线所示温度的关系:t1t2(填“>”、“<”或“=”,下同)
②图2中,两条曲线所示碳水比的关系:x1x2
③图3中,两条曲线所示压强的关系:p1p2
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。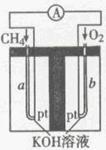
①放电时,正极的电极反应式为
②假设装置中盛装100.0 mL 3.0mol·L-1KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为。
过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如: 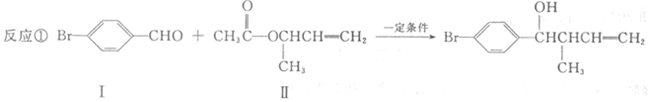
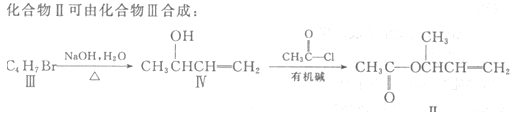
(1)化合物I的分子式为。
(2)化合物Ⅱ与Br2加成的产物的结构简式为。
(3)化合物Ⅲ的结构简式为。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为因此,在碱性条件下,由Ⅳ与CH3CO--Cl反应合成Ⅱ,其反应类型为。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为(写出其中一种)。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质之间的转化关系如图所示。
(1)X的单质与A反应的化学方程式是。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是。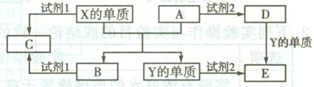
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料为制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是。