(1)常温下,水的离子积KW=__________,则一滴水中(约20滴水为1mL)所含的H+数目为_________个
(2)测得80℃时,纯水中c(H+)=2×10—7,则80℃时浓度为0.2 mol·L-1的Ba(OH)2溶液的pH=______。此温度下将此溶液a L与pH=1的H2SO4溶液b L混合:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=12,则a∶b= ;
③为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,定义AG= 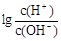 ,则80℃时,该Ba(OH)2溶液的酸度AG=______________。(结果保留对数形式)
,则80℃时,该Ba(OH)2溶液的酸度AG=______________。(结果保留对数形式)
工业上利用电解饱和食盐水可制得重要化工产品。
(1)写出化学方程式并标出电子转移的方向和数目:
(2)氧化剂:
还原剂:
(3)每转移1mol电子,可得到mol氯气;
利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t。
(1)微粒AXn-核外有18个电子,则它的核电荷数为
核内中子数为
(2)有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数。
①写出A的原子结构示意图________________________
元素C的原子核组成符号________________________
②B的阴离子结构示意图________________________
A、B组成的化合物的化学式________________________
对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有SO42-、Na+、CO32- 、H+、NO3-、NH4+、Cl-等离子中的若干种。然后又做了如下实验,以确认这些离子是否大量存在。
①用pH试纸测溶液的pH,试纸显红色;
②取2毫升溶液,用氯化钡和稀硝酸进行检验,结果生成了白色沉淀;
③对②中所得混合物充分静置后,取上层清夜用硝酸银溶液和稀硝酸检验,结果又生成了白色沉淀;
④另取2毫升溶液,加入足量氢氧化钠溶液并加热,没有产生能使湿润红色石蕊试纸变蓝的气体。
试回答下述问题:
(1)原溶液中一定存在的离子是
(2)原溶液中一定不存在的离子是
(3)按上述操作,原溶液中还不能肯定是否存在的阳离子是
检验该阳离子方法是
下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)分离植物油和水________________;
(2)除去粗盐中的泥沙_________________;
(3)与海水晒盐原理相似的是_______;
(4)用四氯化碳在碘水中提取碘_________;
(5)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物(互溶)______;
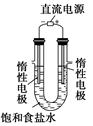
(6分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下图所示:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为 _________________(只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、天平、玻璃棒、烧杯外还有______________________(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,开始时左边电极气泡比较多右边电极气泡比较少,原因是_________________。