Ⅰ、在容积为2.0 L的密闭容器内,物质D在 T ℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题: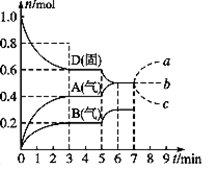
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据上图写出该反应的化学方程式______________,该反应的平衡常数K=____________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(4)若在第7 min时增加D的物质的量,A的物质的量变化正确的是_______(用图中a、b、c的编号回答)。
Ⅱ、可逆反应①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
(5)达平衡(I)时体系的压强与反应开始时体系的压强之比为_____________
(6)达平衡(I)时,X的转化率为_______________
(7)X(g)+2Y(g) 2Z(g) 是_______热反应。
2Z(g) 是_______热反应。
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: 。请根据图示回答下列问题:
。请根据图示回答下列问题:
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2)写出该反应的热化学方程式________________
(3)恒容条件下,下列措施中能使 增大的有________________
增大的有________________
A升高温度B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
(4)若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是________
A c1=c2 B. 
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(5)若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________
碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L—1的氨水,溶液中随着水量的增加而减小的是_____________(填序号)
(2)标准状况下,将1.12LCO2通入100mL1mol·L—1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为_________________________________________________;
①c(OH—)=2c(H2CO3)+______________________________________________;
②c(H+)+c(Na+)=___________________________________________________。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则 原电池工作时电解质溶液中向正极移动的离子是_____________。
原电池工作时电解质溶液中向正极移动的离子是_____________。
已知五种短周期元素在周期表中的相对位置如下表所示。
| A |
|||||
| B |
|||||
| c |
d |
e |
(1)上述元素中离子半径最大的是_______________(填写元素符号)。
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成。它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:①A、B、E所含的该金属元素的原子结构示意图为_________________________________________;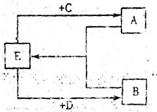
②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为______________________________________________________________。
反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=akJ·mol—1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g)△H=bkJ·mol—1
FeO(s)+CO(g)△H=akJ·mol—1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g)△H=bkJ·mol—1
测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)若500℃时进行反应①,CO2起始浓度为2mol·L—1,CO的平衡浓度为_____________。
(2)反应①中的a__________0(填大于、小于、等于)。
(3)700℃反应①达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有__________(填序号)
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
(4)下列图像符合反应①的是___________(填序号)(图中 是速率、
是速率、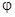 为混合物中CO含量,T为温度且T1>T2)
为混合物中CO含量,T为温度且T1>T2)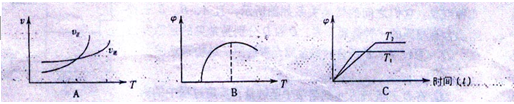
(5)由反应①和②可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=__________。
(14分)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。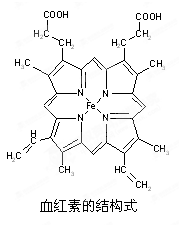
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是_______________,写出基态Fe原子的核外电子排布式_________________。
⑵血红素中N原子的杂化方式分别为________、________,在右图的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为_________,δ、α两种晶胞中铁原子的配位数之比为____________。