(14分)A、B、C、D、E五种元素均位于短周期,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述元素中的两种或三种组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙,反应条件省略)的浓溶液反应,分别是甲+M→X+Y+Z,乙+M→Y+Z+W,且X、Y、W均能与Z反应。回答下列有关问题:
(1)若将标准状况下一定量的X充入试管后将其倒立于水槽中,待水不再上升时,试管内溶质的物质的量浓度是 (假设溶质不扩散)。
(2)若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式 。
(3)G是一种既能与强酸反应又能与强碱反应的酸式盐,则G的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)。
(4)由E形成的单质能与热的浓NaOH溶液反应生成两种具有还原性的盐,写出该反应的化学方程式 ,氧化剂和还原剂的质量比为 。
下表是元素周期表的一部分:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅧA |
| 1 |
① |
||||||
| 2 |
② |
③ |
④ |
⑤ |
⑥ |
||
| 3 |
⑦ |
⑧ |
⑨ |
⑩ |
(1)表中元素⑩的氢化物的化学式为,此氢化物的还原性比元素⑨的氢化物的还原性(填强或弱)
(2)某元素原子同一能层中p能级电子数比s能级电子数少1,则该元素的元素符号是
(3)俗称为“矾”的一类化合物通常含有共同的元素是
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是(填元素符号)。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的原子结构示意图为;
(3)D元素的正三价离子的3d亚层为半充满,其二价离子的电子排布式为
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E基态原子的电子排布式为。
下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
—— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
—— |
| 最低价态 |
—— |
—— |
-2 |
—— |
-4 |
-3 |
-1 |
—— |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号)
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式),某元素R的原子半径为1.02×10-10m,该元素在周期表中位于,若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式。
在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=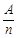 (K为A与n的比值)。请用编号回答下列问题:
(K为A与n的比值)。请用编号回答下列问题:
A.两性B.金属C.非金属D.稀有气体
(1)当n一定时,K值越大,则元素的_____性越强
(2)当A一定时,K值越小,则元素的_____性越强
(3)当K=0,则该元素系_____元素,当K=l时,则该元素系_____元素,当K<1时,则该元素系____元素。
(A)
⑴ 在上面元素周期表中画出金属元素与非金属元素的分界线
⑵ 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的____________族。
⑶ 现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应为黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲元素与硫元素相比较,非金属性较强的是______________(填名称),
写出可以验证该结论的一个化学反应方程式___________________________________。
(B)
⑴ 在上面元素周期表中全部是金属元素的区域为___________。
(a)A(b)B(c)C(d)D
⑵ 有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______________。
⑶ 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是______________(填名称),
可以验证该结论的实验是_____________________________。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性