(15分)目前工业合成氨的原理是N2(g)+3H2(g) 2NH3(g) △H=一93.0kJ·mol-1
2NH3(g) △H=一93.0kJ·mol-1
(1)已知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=十l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为 。
4NH3(g)+3O2(g) △H=十l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为 。
(2)如图,在恒温恒容装置中进行合成氨反应。
①表示N2浓度变化的曲线是 。
②前25 min内,用H2浓度变化表示的化学反应速率是 。
③在25 min末刚好平衡,则平衡常数K= 。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
| A.气体体积不再变化,则已平衡 |
| B.气体密度不再变化,尚未平衡 |
| C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动 |
| D.平衡后.压缩容器,生成更多NH3 |
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如图。
请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为 。
(6)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。680℃时所得固体的化学式为 (填字母序号)。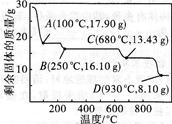
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。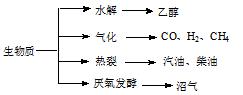
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α 2 |
α3 |
下列说法正确的是。
a. c1=c2 b. 2Q1=Q3 c. K1=K3 d. α2+ α3<100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)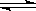 CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)=mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。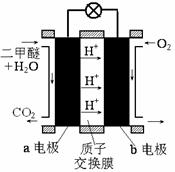
b电极是极;a电极的反应式为。
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为。
⑵下面给出了几个分子和基团化学键的键能(E):
| H2 |
O2 |
F2 |
O-H |
O-F |
H-F |
|
| E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
请计算反应:2HFO=2HF+O2的反应热(△H)的近似值为kJ/mol。
⑶次氟酸刹那间能被热水所分解,生成一种常见的物质H2O2,写出次氟酸与热水反应的化学方程式:。
(4)1986年,化学家Karl Christe首次用2K2MnF6 + 4SbF5 ="==" 4KSbF6 + 2MnF3 + F2↑化学方法制得了F2。该反应中被还原的元素化合价从价变为价,若反应中生成标准状况下11.2 L的F2,则有mol电子发生转移。
能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g)△H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g)△H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g)△H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。
下列说法中正确的是_____________(填字母序号)。
| A.负极的电极反应式为:CO + O2-―2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移 |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
| 物质 |
CO |
H2 |
CH3OH |
| 浓度/(mol·L-1) |
1.2 |
1.0 |
0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率v(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)。
有机化合物A~H的转换关系如下所示: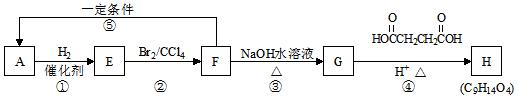
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol O2,则A的分子式为_______________,结构简式为_________________,A的名称是_______________________。
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是_____________________________________________________________________。
(3)G与金属钠反应能放出气体。G分子中所含官能团的名称是___________________;由G转化为H的化学方程式是_______________________________________________。
(4)①的反应类型是______________;③的反应类型是_______________。
(5)写出由F转化为A的反应条件是_________________________。
(6)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B所有可能的结构简式:__________________________________________。
(7)丁二酸(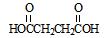 )与乙二醇(HOCH2CH2OH)在催化剂作用下,经聚合反应可制成一种新型可生物降解的高分子材料。请写出该聚合物的结构简式:
)与乙二醇(HOCH2CH2OH)在催化剂作用下,经聚合反应可制成一种新型可生物降解的高分子材料。请写出该聚合物的结构简式:
_____________________________________________________。
(18分) 0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为_________________。若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃的结构简式为_________________,名称是_________________。
若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于_______ 烃,结构简式为_______________,名称是 _________________。