随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)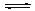 N2(g)+2CO2(g);△H<0.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= .
N2(g)+2CO2(g);△H<0.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= .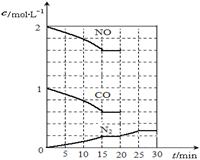
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).
20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出肼与亚硝酸反应的化学方程式 .
(4)如图所示装置可用于制备N2O5,则生成N2O5的那一极电极反应式为 .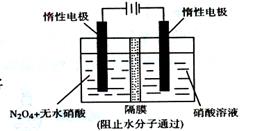
在一个2L的密闭容器中,发生反应2SO3(g) 2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:
(1)写出该反应的平衡常数表达式_______________ 。
(2)用O2表示0~8min内该反应的平均速率v= 。
(3)升高温度, K值将 ;容器中气体的平均相对分子质量将 。(填“增大”“减小”或“不变”)
(4)从8min起,压缩容器为1L,则SO3的变化曲线为
| A.a | B.b | C.c | D.d |
(5)计算该温度下的平衡常数K=
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_______________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=_____ ___mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为_____ ___。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为_____ ___。
830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.010" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.010" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
A.v逆(A)=2v正(B) B.容器内压强保持不变
C.v(C)=2v(B) D.容器内气体的密度保持不变
(2)若在相同的容器中加入0.100 mol A和0.050molB,500℃时充分反应达平衡后,放出热量Q2kJ,则2Q1 Q2(填“>”、“<”或“=”);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)<K(350℃),该反应是 (填“放热”或“吸热”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出表示碳燃烧热的热化学方程式
(2)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“正向”、“逆向”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“正向”、“逆向”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
②已知:O2(g)  O2+(g)+e- △H1=+1175.7 kJ·mol—1
O2+(g)+e- △H1=+1175.7 kJ·mol—1
PtF6(g)+e- PtF6-(g) △H2=-771.1 kJ·mol—1
PtF6-(g) △H2=-771.1 kJ·mol—1
O2PtF6(s) O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol—1
O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol—1
则反应O2(g)+PtF6(g)  O2PtF6 (s)的 △H=_____________
O2PtF6 (s)的 △H=_____________