有机物A(C6H8O4)为食品包装纸的常用防腐剂,A难溶于水但可以使溴的CCl4溶液褪色。A在酸性条件下水解反应,得到B(C4H4O4)和C。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。C的一种同系物是人类广泛使用的饮料成分。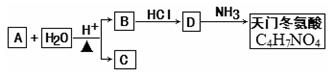
(1)A可以发生的反应类型有 (选填序号)
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称 、
(3)B分子中没有支链,则B的结构简式 ,和B具有相同官能团的同分异构体的结构简式
(4)由B制取A的化学反应方程式 ,该反应类型
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一。结合上述反应流程,推断天门冬氨酸的结构简式
(6)两分子天门冬氨酸一定条件下可以缩合生成一种六元环肽结构的物质,写出该反应的化学方程式
已知物质A、B、C、D、E、F、G、H、I、J、X、Y有如下图所示的转化关系,其中气体A、B、C为常见非金属单质,X、Y为常见金属单质。(部分反应中生成物没有全部列出,反应条件未全部列出)
请按要求回答下列问题:
(1)气体E的电子式为;
(2)G的化学式是___________;
(3)写出反应“I→J”的离子方程式;
(4)金属X与NaOH溶液反应也能得到溶液H,试写出对应的化学方程式。
(1)(3分)有下列有机物:
a.  b.
b. 
c.  d.
d. 
①互为同分异构体的是_______________。
②互为同系物的是_______________。
③核磁共振氢谱只有一个峰的是_______________。
(2)(6分)柠檬酸结构简式为:
①柠檬酸中的官能团有____________。
②1 mol柠檬酸最多可消耗NaOH溶液的物质的量为_______________mol。
③柠檬酸不能发生的反应为_______________。
a.酯化反应 b.加成反应 c.氧化反应 d.消去反应 反应①、③消耗Br2的物质的量之比为___________;物质B的结构简式为_____________。
反应①、③消耗Br2的物质的量之比为___________;物质B的结构简式为_____________。
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着工业化、城镇化的快速发展,我们所生存的环境也面临越来越严峻的污染问题,如酸雨的形成、汽车尾气污染、工业废气污染、大量生活垃圾的产生等。
①下列措施不能够改善环境质量的是(填字母)。
a.对所有垃圾通过露天焚烧的方式进行处理
b.给汽车排气管加装尾气催化净化装置以减少尾气污染
c.在煤炭中添加生石灰以减少酸雨的发生
②城市空气质量监测中,不需要监测的指标的是(填字母)。
a.SO2浓度 b.NOx浓度 c.可吸入颗粒物的含量 d.CO2浓度
③现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是
(填字母)。
a.烹饪时产生的油烟 b.石材缓慢释放的放射性气体
c.各种板材中粘合剂释放的甲醛等 d.天然气燃烧产生的CO2和水
⑵(6分)化学与新材料开发密切关联,化学是人类进步的关键。
①近日,《中国航空报》透露了一条重大消息,中国在先进高温合金领域不断获得重大成果。可以说,没有高温合金,就没有今天先进的航空发动机。下列物质中不属于合金的是(填字母)。
a.硬铝 b.玻璃钢 c.不锈钢 d.黄铜
②新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于(填“合成纤维”、“合成橡胶”或“塑料”)材料。环保型聚乙烯塑料袋可以用于食品包装,合成该聚合物的反应可表示为。
③随着电解工业的发展,铝制品已经被人类广泛使用,但是常温下不可以用铝制容器盛装的是(填字母)。
a.浓氢氧化钠溶液 b.浓硫酸 c.浓硝酸 d.啤酒
在室外,不能将铜质电线和铝质电线直接相连接,否则会因发生腐蚀而形成安全隐患。
⑶(6分)合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有性。
②(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是。
经测定某苯的含氧衍生物相对分子质量为122。
(1)若该物质分子中只含一个氧原子,则其化学式为,如果其分子中没有甲基,则它遇FeCl3溶液(填“能”或“不能”)发生显色反应,如果其遇FeCl3溶液会发生显色反应,则这样的结构共有种。
(2)若该物质分子中含有两个氧原子,则其化学式为,其可能的结构共有
种,其中用水能与其他同分异构体区别出来的是(写出结构简式)。
含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能使甲基橙溶液变红,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)=
(2)该有机物的摩尔质量为,写出分子式
(3)该有机物的可能结构简式有