原电池产生电流的本质原因是
| A.原电池中电解质溶液能电离出自由移动的离子 |
| B.有两根导线将两个活动性不同的电极连接 |
| C.电极上进行的氧化还原反应的生成物为电子 |
| D.电极上进行氧化还原反应时有电子的定向移动 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0. 6 mol·L-1·s-1;③2 s时物质A的转化率为70%;④2 s时物质B的浓度为0.7 mol·L-1其中正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1;②用物质B表示的反应的平均速率为0. 6 mol·L-1·s-1;③2 s时物质A的转化率为70%;④2 s时物质B的浓度为0.7 mol·L-1其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32―、SO32―、SO42―、C1―、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下: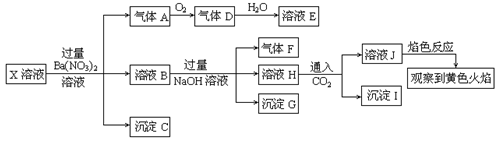
下列结论正确的是
| A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42― |
| B.气体F经催化氧化可直接生成气体D |
| C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3 |
| D.X中不能确定的离子是 A13+、Na+、K+和C1― |
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.在常温常压下,11.2 L N2含有的分子数为0.5 NA |
| B.在常温常压下,1mol Ne含有的原子数为NA |
| C.22.4lCl2所含原子数为2NA |
| D.在同温同压下,相同体积的任何气体单质所含的原子数相同,而Ne由一个原子构成。相同状况下,相同体积的上述气体所含原子数就不相同。 |
设NA为阿伏伽德罗常数的值,下列说法中正确的是
| A.常温下,16gO2和O3的混合气体中含有l.5NA个氧原子 |
| B.常温下,1Llmol·L-1Na2CO3溶液中所含的CO32-为NA |
| C.58g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| D.常温常压下,足量的Fe在lmolCl2中充分燃烧,转移的电子数为2NA |
短周期元素X的原子最外电子层中具有最多的未成对电子,元素Y的价电子排布式为nsnnpn+2,则X、Y组成的微粒中,不可能存在的是
| A.X2Y5 | B.XY42- | C.XY2- | D.XY3- |