图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
| 元素编号 |
A |
B |
C |
D |
E |
| 电负性 |
3.0 |
2.5 |
X[ |
1.5 |
0.9 |
| 原子半径(单位nm) |
0.099 |
0.102 |
0.110 |
0.143 |
0.186 |
| 主要化合价 |
-1,+7 |
-2,+6 |
-3,+5 |
+3 |
+1 |
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
(2)X的值应为 (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系 ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是: (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是,GaAs中Ga的化合价为。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为;
AsH3的沸点高于PH3,其主要原因为。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为,与其互为等电子体的分子的化学式为(任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。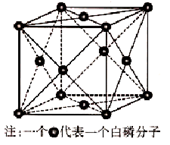
目前,我省多地正在积极推广使用太阳能。常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为______。
(2)砷、碲是第四周期的相邻元素,已知砷的第一电离能(947kj • mol-1)大于碲 (941 kj • mol-1)。请从原子结构的角度加以解释_________。
(3)As2O3俗名砒霜,是一种剧毒物质。法医检验砒霜中毒的方法是:向试样中加入锌 粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”。请用化学方程式表示检验原理:
__________________、__________________
(4)硼酸(H3BO3)在水溶液中易结合一个OH—生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________。
②[B(OH)4]-的结构式为____________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体 硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂)。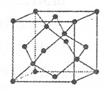
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______ (用化学式表示
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有______个氮原子、______个硼原子,立方氮化硼的密度是______g • cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(2014届北京市东城区高三下学期零模诊断理综化学试卷)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下: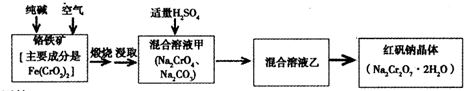
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下: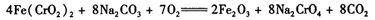
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:
①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。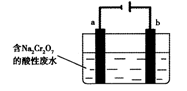
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
(2014届浙江省温州市高三第一次适应性测试理综化学试卷)
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下: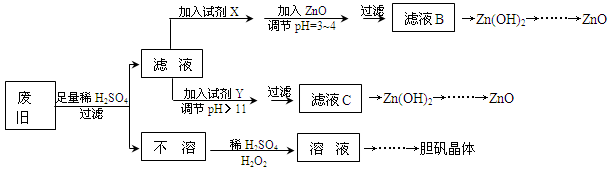
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ |
Fe2+ |
Zn2+ |
|
| 开始沉淀的pH |
1.1 |
5.8 |
5.9 |
| 沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-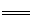 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32-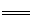 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
(2014届福建省漳州市八校高三第三次联考理综化学试卷)
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: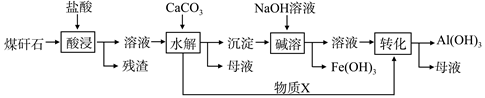
(1)“酸浸”过程中主要反应的离子方程式为__________ 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____ ________、_____ ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓; 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。