A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A , C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素的最高价氧化 物的水化物之间的相互反应的化学方程式: 。
物的水化物之间的相互反应的化学方程式: 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取: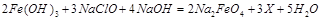 ,则X的化学式为。
,则X的化学式为。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为。
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为。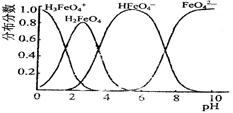
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为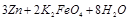

 则电池正极材料是,充电时电池正极(填“得”“失”)电子,放电时电池的负极反应式为。
则电池正极材料是,充电时电池正极(填“得”“失”)电子,放电时电池的负极反应式为。
X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下: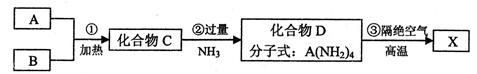
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可做光导纤维。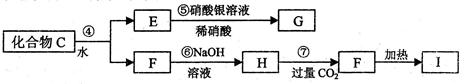
按要求回答下列问题:
(1)C的化学式为;X的化学式为 。
。
(2)写出下列方程式
反应②的化学方程式 ;
;
反应⑦的离子方程式。
合成氨反应(
 2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题:
2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题: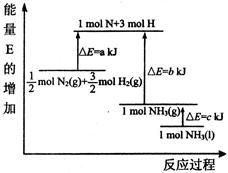
(1)合成氨反应的能量变化如图所示,则该反应的热化学方式为(△H用图给字母表示)。
(2)在温度恒定为298K,体积恒定为10L的密闭容器中测得合成氨反应达到平衡时氢气、氮气、氨气的物质的量分别为0.1mol、0.4mol、4mol,则此温度下题给该反应的平衡常数K=
(3)标况下,若将22.4mL的氨气通入100mLpH为2的盐酸中,则溶液中各离子浓度的顺序由大到小为。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入足量的CO2,过滤后即可得到(NH4)2SO4。该过程的化学方程式为,由此可知Ksp(CaSO4)Ksp(CaCO3)(填“大于”、“小于”或“等于”)
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。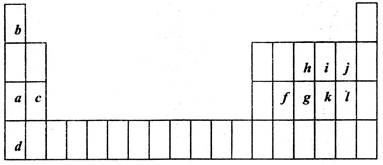
请你根据表中所给元素,回答下列问题:
(1)在短周期的所有元素中的原子半径与的原子半径之比最小(不包括稀有气体)(填元素符号)。
(2)金属性最强的元素与氧气反应生成化合物的化学式是(填两种即可),j和k氢化物比较,稳定性强的是(填写氢化物化学式)。
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质做消毒杀菌剂的原因是(用化学方程式表示)
(4)常温下某液态化合物只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中(选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。


甲乙丙