微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体,将有机物的化学能转化为电能。以葡萄糖溶液作底物为例,其工 作原理如右图所示。
作原理如右图所示。
 已知石墨电极上反应为:
已知石墨电极上反应为:
C6H12O6+6H2O-24e- 6CO2+24H+
⑴ 电池中的质子交换膜只允许质子和水分子通过。电池工作时,质子移向电源的 极,铂碳上所发生的电极反应式为_____________。
⑵燃烧热是指1摩尔物质完全燃烧生成稳定的物质(如H转化为液态水,C转化为二氧化碳 )所放出的热量。葡萄糖的燃烧热为2800kJ/mol,写出葡萄糖燃烧的热化学方程式 。
⑶ 化学需氧量(COD)是重要的水质指标,其数值表示将1L水中的有机物氧化为CO2、H2O所需消耗的氧气的质量。科学家设想利用微生物燃料电池来处理某些污水,并进行发电,该设想已经在实验室中获得成功。但如果1L废水中有机物(折算成葡萄糖)氧化提供的化学能低于5.6kJ,就没有发电的必要。则下列污水中,不适合用微生物燃料电池发电的是 (填序号)。
| 序号 |
A |
B |
C |
D |
E |
| 污水类型 |
生活污水 |
印染 |
电镀 |
造纸 |
硫酸工业废水 |
| COD值(mg/L) |
520 |
870 |
20 |
960 |
120 |
选做(12分)【化学——有机化学基础】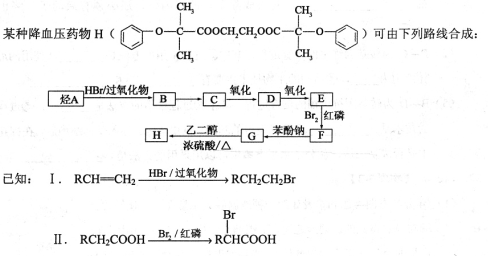
回答下列问题:
(1)A的名称为________。
(2)B→C的反应条件为________,E→F的反应类型为________。
(3)D的结构简式为________。
(4)符合下列条件G的同分异构体有________种,其中核磁共振氢谱为5组峰的为__________(写结构简式)。
①能使 FeCl3溶液显紫色;
②苯环上只有2个取代基;
③lmol该物质是多可消耗3molNaOH。
(5)G→H的化学方程式为________。
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图: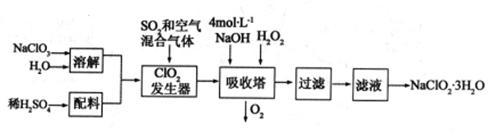
己知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出ANClO2.3H2O
②
(1)吸收塔内发生反应的离子方程式为________。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2若用二氧化氯和浓盐酸反应制取Cl2,当生成5molCl2时,通过还原反应制得氯气的质量为________g。
(2)从滤液中得到NaClO2.3H2O晶体的所需操作依次是________(填写序号)。
a.蒸馏
b.灼烧
c.过滤
d.冷却结晶
e.加热蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为_________(用化学式表示);
体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:________(填“前者大”“相等”或“后者大”)。
②是常用的沉淀剂。某工业污水中含有等浓度的Cu2+ 、Fe2+ 、Pb2+离子,滴加Na2S 溶液后首先析出的沉淀是________;当最后一种离子沉淀完全时(该离子浓度为l0 mol/L),此时体系中的S2-的浓度为____________.
mol/L),此时体系中的S2-的浓度为____________.
运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下: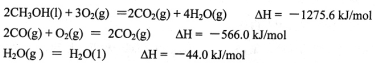
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时问内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________;SO3的转化率为________(保留小数点后-位):T℃时,反应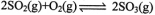 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。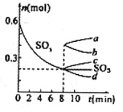
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
电池正极的电极反应式是_____电解质溶液的pH______(填写增大、减小、不变),A.物质是______(写化学式)。
将E 和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 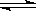 2G(g)。
2G(g)。
若忽略固体体积,平衡时 G 的体积分数随温度和压强的变化如下表所示。请填写下列空格: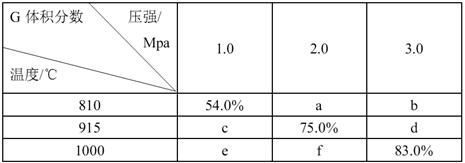
(1)表中数据b f。(选填“>”、“<”或“=”)
(2)该反应的熵变ΔS0,ΔH0。(选填“>”、“<”或“=”)
(3)根据表中数据,可计算求得915℃、2.0MPa时E 的转化率为。
(4)上述反应达到平衡后,若保持体系温度不变,下列措施中能提高混合体系中气体E的体积分数的是
| A.保持容器容积不变,充入一定量的气体 E |
| B.保持容器内压强不变,充入一定量的气体 G |
| C.加入少量固体F的粉末 |
| D.保持容器容积不变,同时充入一定量的气体 E 和G |
(10 分)已知甲酸铜遇水易水解而具有还原性。实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
回答下列问题:
(1)研磨时应该将固体原料放在(填仪器名称)中;制备 Cu2(OH)2CO3时需要用到70℃~80℃的热水溶解小苏打和胆矾的混合物,其目的是。
(2)写出用小苏打、胆矾制备 Cu2(OH)2CO3的离子方程式;实际操作中的小苏打与胆矾的物质的量之比大于 2∶1,原因是。
(3)操作a 的名称是。
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净的实验方法是。
(5)实验中用无水乙醇洗涤产物的目的是。