下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
草药莪术根茎中含有一种色素,它的结构为CH2—(—CO—CH=CH— —OH) 2,用它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大量分别为
—OH) 2,用它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大量分别为
| A.3mol,3mol | B.3mol,5mol | C.6mol,8mol | D.6mol,10mol |
美国康乃尔大学的魏考克斯(C. Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(如右图,所有原子在同一平面上)。有关该有机分子的说法正确的是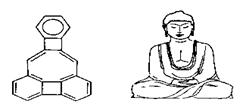
A.该有机物属于芳香族化合物B.该有机物属于苯的同系物
C.该有机物分子中含有20个碳原子D.该有机物一氯代物只有3种
在下列有关说法中正确的是
①相同质量的CH4、C2H4、C2H2完全燃烧时耗O2量的关系为CH4 > C2H4 >C2H2
②对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
③对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,完全燃烧后产生的CO2物质的量也不改变
④某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,则该有机物的类型肯定为烷烃
| A.①②③ | B.①②③④ | C.②③ | D.以上组合均不正确 |
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为:
下列关于咖啡酸的说法中,正确的是
| A.属于芳香烃 | B.分子式为C9H7O2 |
| C.与过量的浓溴水发生反应生成白色沉淀 | D.不能使酸性KMnO4溶液褪色 |
设阿伏加德罗常数为NA,则下列说法正确的是
| A.15g甲基(-CH3)所含有的电子数是10NA |
B.0.5mol 1,3一丁二烯分子中含有的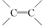 数为NA 数为NA |
| C.标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA |
| D.常温常压下,1mol丙烷所含有的共价键数目为12NA |