某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
将一定量的FeO、Fe2O3、Fe3O4混合粉末与一定量铝粉均匀配成铝热剂并分成两份,第一份在高温下恰好完全反应生成氧化铝和铁,然后将生成物与足量稀硫酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比可能是()
| A.3:4 | B.1:l | C.5:6 | D.2:3 |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-l Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如下图所示。下列说法正确的是()
| A.a点的沉淀总物质的量为0.025mol |
| B.oa段发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| C.ab段发生反应的离子方程式是: NH4++SO42-+Ba2++OH-=NH3·H2O+BaSO4↓ |
| D.反应至c点,加入Ba(OH)2溶液的总体积为250 mL |
铅蓄电池是一种典型的可充电电:池。电池总反应式为:
Pb+PbO2+4H++2SO42-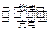 2PbSO4+2H2O
2PbSO4+2H2O
下列说法正确的是()
| A.放电时:电子流动方向由A经导线流向B |
| B.放电时:两极质量增加相等 |
| C.充电时:铅蓄电池的负极应与充电器电源的正极相连 |
| D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+ |
将Fe和Cu的混合粉末ag加入到100mL4mol/L稀硝酸中充分反应后(假设通原产物只有NO),下列说法正确的是()
| A.若反应后有Cu剩余,则反应后溶液中含有的金属阳离子一定是Cu2+ |
| B.若反应后的溶液中有Cu2+,则反应后溶液中含有的金属阳离子一定是Fe2+、Fe3+ |
| C.若反应后的溶液中无金属剩余,则加入金属粉末质量8.4 g<a<9.6 g |
| D.若加入的Fe和Cu的质量比为7:8,则使HN03完全反应的金属粉末质量最小为7.2 g |
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法不正确的是()
| A.x="4" |
| B.每生成1 mol Fe3O4,反应共转移2mol e- |
| C.Fe2+和S2O32-都是还原剂 |
| D.1 mol S2O32-被氧化时,被S2O32-还原的O2为0.25mol |