为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)合成氨反应:1/2N2(g)+3/2H2(g) NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成34 gNH3(g),放出92.2 kJ的热量。请回答下列问题:
NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成34 gNH3(g),放出92.2 kJ的热量。请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),图中ΔH=_________
(3)由气态基态原子形成1mol化学键释放的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值____。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值____。
(4)已知:△H2="+" 44 kJ·mol-1,△H3= -285.8kJ·mol-1
下图列出它们之间的转变关系。请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1= (用△H2、△H3表示△H1计算等式), (计算△H1数据结果)。
用电子式表示下列物质的形成过程:
MgF2______________________________________________
Br2_______________________________________________
H2S__________________________________________________
原电池是将_______能转化为______能的装置.其中,电子流出的一极是原电池的______极,该极发生________反应.
用化学式填写下列空白:元素周期表的第三周期元素中,除稀有气体外,原子半径最大的是________;最高价氧化物对应的水化物碱性最强的是___________;最高价氧化物对应的水化物呈两性的是___________;最高价氧化物对应的水化物酸性最强的是___________.
A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。这些物质之间满足如图所示的转化关系,图中部分生成物已略去。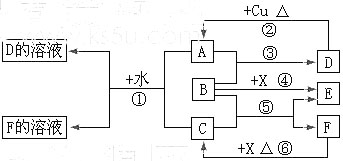
(1)写出下列物质的化学式:A,F。
(2)B的电子式为。根据图中信息,B、C、X的氧化性由强到弱的顺序是(用化学式表示)。
(3)写出反应①的离子方程式;
写出反应⑥的离子方程式。
(4)在反应⑥中,F表现的性质是,当生成0.75 mol C时,被氧化的还原剂的物质的量是。
硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步:
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2 8SO2+2Fe2O3,该反应的氧化产物是,当生成8 mol SO2时转移电子的物质的量为。
8SO2+2Fe2O3,该反应的氧化产物是,当生成8 mol SO2时转移电子的物质的量为。
(2)第二步,在接触室中发生如下反应:2SO2+O2  2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1α2(填“大于”、“等于”或“小于”)。
2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①浓硫酸可以与多种物质发生化学反应,试写出浓硫酸与铜发生反应的化学方程式。
②有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H25.6 L,则此混和物的组合方式最多有种。