高炉炼铁过程中发生的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.653 |
42.875 |
(1)写出该反应的平衡常数表达式:K=____ _____。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= ;平衡时,c(CO)= 。
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的体积
F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是 。
| n(Fe2O3) |
0.350 |
0.027 |
0.080 |
0.080 |
| n(CO) |
0.010 |
0.010 |
0.010 |
0.050 |
| n(Fe) |
0.100 |
0.064 |
0.080 |
0.080 |
| n(CO2) |
0.035 |
0.088 |
0.040 |
0.050 |
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀 ________。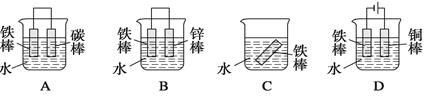
某溶液中可能含有SO42―、CO32―和NO3―,为了检验其中是否含有SO42―,正确的操作方法是取少量溶液置于试管中为排除干扰应先加:
再加
可能发生的离子反应方程式是:
现有200mL H2SO4和Na2SO4的混合溶液,其中硫酸的物质的量浓度为1 mol/L,硫酸钠的物质的量浓度为0.5mol/L。若要配制硫酸和硫酸钠的物质的量浓度分别为2mol/L和0.2mol/L的混合溶液,应加入55.8%的硫酸溶液(密度为1.35g/cm3)多少毫升?最后所得混合溶液的体积是多少毫升?
实验室用Na2CO3·10H2O晶体配制240mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)用托盘天平称取Na2CO3·10H2O的质量为g。
(2)操作中所需仪器除托盘天平、烧杯、玻璃棒外,还需要(填仪器名称)。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次);
| A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡 |
| B.用托盘天平称量所需的Na2CO3·10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解 |
| C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,振荡摇匀 |
E.改用胶头滴管加水,使溶液凹液面的最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)溶液注入容量瓶前需恢复到室温,这是因为;
(5)若出现如下情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①没有进行A操作;
② 称量时,Na2CO3·10H2O已失去部分结晶水;
③ 若定容时俯视刻度线;
④ 定容摇匀时,发现液面下降,又加水至刻度线;
⑤ 容量瓶用蒸馏水洗净后没有干燥。
右图为实验室制取蒸馏水的装置示意图。请根据图示回答下列问题: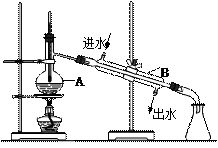
⑴ 图中两处明显的错误是:
,
。
⑵ A仪器的名称是 ,B仪器的名称是。
,B仪器的名称是。
⑶ 实验时A中除加入适量自来水外,还需加入少量,其作用是。
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,一位同学设计了一种制备精盐的实验方案,步骤如下(用于生成沉淀的试剂均稍过量):

(1) 判断BaCl2已过量的方法是______________________________。
(2) 第④步中,相关的离子方程式是_________________________________。
(3)蒸发、结晶时,当中剩余时停止加热。