一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如下图所示。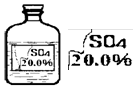
要求同学们进行探究:
确认这瓶溶液到底是什么溶液?
提出猜想:王老师提示:这瓶无色溶液只能是以下四种溶液中的一种:
①硫酸镁溶液、 ②硫酸钠溶液、
③硫酸溶液、 ④硫酸铵溶液。
查阅资料:
A:常温下,相关物质的溶解度如下
| 物质 |
MgSO4 |
Na2SO4 |
(NH4)2SO4 |
H2SO4 |
| 溶解度 |
35.1g |
19.5g |
75.4g |
与水任意比互溶 |
B:(NH4)2SO4的水溶液显酸性
【实验探究】
(1)通过查阅资料,小明同学认为猜想 (填序号)不成立,原因是 。
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
| 实验步骤 |
实验现象 |
实验结论 |
| a取该溶液少许于试管中,向其中滴加几滴氢氧化钠溶液 |
溶液中有白色沉淀生成 |
猜想①成立 |
| b取该溶液少许于试管中,向其中滴加几滴紫色石蕊溶液 |
|
猜想③成立 |
小芳同学认为小明实验步骤b的结论不正确,她的理由是 ;
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 |
实验现象 |
实验结论 |
| 取该溶液少许于试管中,再往该溶液加入 溶液,加热。 |
|
猜想④成立,该反应的化学方程式为 |
实验室中,利用下列装置可以制取某些气体,请回答下列问题。
(1)写出图中标号仪器的名称:①_______________ ②_______________
(2)向气体发生装置内加入药品前,应该进行的操作是。
(3)实验室用过氧化氢和二氧化锰混合制取氧气的文字表达式为 ,应选用的发生装置为,收集装置为。
(4)实验室用氯化铵和熟石灰固体加热来制取氨气,应选用的发生装置为 ,只能用装置C收集,而不能用D或E收集,则推测氨气具有的物理性质为 。
(8分)某化学兴趣小组的同学采用了下图所示装置测定空气中氧气含量。
【实验步骤】:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
【实验分析】(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是。
(2)写出该实验过程中玻璃管内的现象为
写出该反应的文字表达式。
(3)小强实验操作均正确,测得实验结果如下:
| 反应前注射器内气体总体积 |
反应后注射器内气体总体积 |
| 25mL |
mL |
【实验结论】:该实验得出的结论为 。
【实验反思】:小红同学实验误差较大,请你帮她分析造成实验误差的原因
(请写出其中一条)。
近几年我国某些城市空气受到污染,形成酸雨较为严重,主要是因为大量燃烧含硫量高的煤而形成的;此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 H2SO4。
(1)高锰酸钾中锰元素的化合价为价。
(2)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。请写出二氧化硫与澄清石灰水反应的化学方程式:。
根据上述资料,甲同学、乙同学、丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学的实验操作:甲同学进行了如下图所示A、B两步实验:
“实验现象”: A中稀高锰酸钾溶液褪色, B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:。
(5)丙同学的实验操作:丙同学进行了如图所示实验(部分装置在图中略去)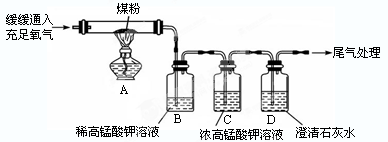
【探究与结论】(6)上图C装置的作用是。
(7)要证明煤中含有碳元素和硫元素,丙同学实验中的现象是:B
CD。
(14分)根据下图所示,按要求回答问题:
(1)图中仪器a的名称是,图F实验的目的是。
(2)实验室制取二氧化碳的化学方程式为;
所选用的发生装置是(填序号)。
(3)实验室加热氯酸钾和二氧化锰制氧气时,在该反应中质量和化学性质都没有改变的物质是,收集氧气所选用的装置是(填序号)。
(4)在2011年5月喀左县初升高化学实验操作考试中,小红用A、E装置认真完成了双氧水和二氧化锰制取氧气的实验,请据此实验回答下列问题。
①双氧水和二氧化锰发生反应的化学方程式为 。
②在实验过程中,小军同学由于动作太慢,氧气还没有收集满,,锥形瓶内的反应就已经停止。若想集满这瓶氧气,在不拆卸装置的前提下,请你帮他想出可行的办法。
方法是。
③小明同学认为,这套装置的缺点是不能控制反应随时发生、随时停止,造成了药品的浪费。为了解决小明提出的问题,请你对原实验装置加以改进,或设计新的简易实验装置,以便有效地控制双氧水的分解反应。
友情提示:你可从下列用品中选取,也可自行选用其它仪器。
请你在下表中至少写出两种方案:
| 方案一 |
方案二 |
工业用碳酸钠溶液与石灰水反应制烧碱。对于碳酸钠溶液与石灰水是否恰好完全反应,化学小组同学将其产物进行过滤,并对滤液进行如下探究。
提出假设:假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和氢氧化钙
假设三:滤液中含氢氧化钠和碳酸钠
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
甲同学设计了如下实验方案:已知:Na2CO3 + CaCl2= 2NaCl+CaCO3↓(白色)
| 实验步骤 |
实验现象 |
结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 |
若生成白色沉淀 |
碳酸钠过量 |
| 若无明显现象 |
恰好反应 |
试回答:
(1)写出碳酸钠溶液与石灰水反应的化学方程式。
(2)哪种假设不合理,试说明理由。
(3)乙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是。
(4)丙同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
| 实验步骤 |
实验现象和结论 |
(5)取18.6g氢氧化钠样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/10向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗盐酸的质量(所得数据如右图)。试计算: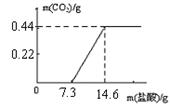
①盐酸中溶质的质量分数为。
②样品中碳元素的质量分数为。