Na2SO4是制造纸张、药品、染料稀释剂的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如下图所示。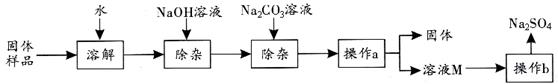
(1)加入NaOH溶液主要除去的阳离子是 (填离子符号),其反应的化学方程式为 。
(2)若加入的NaOH溶液和Na2CO3溶液都过量,可在后续的流程中加入适量的 (填名称)除去。
(3)操作a的名称是 ,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、 。
(4)若溶液M中的溶质是Na2SO4和NaCl,根据下图的溶解度曲线可知,操作b应为:先将溶液M ,再降温结晶、过滤。降温结晶的最佳温度范围是 ℃以下,这是因为 。 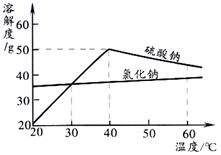
可燃物与氧气接触时发生燃烧。当氧气充足时,可燃物,此时可燃物中的碳、氢元素分别生成和;当氧气不充足时,可燃物,此时可燃物中的部分碳、氢生成、等有毒气体和小的颗粒等物质。
在赤壁之战中,周瑜的军队点燃战船,熊熊燃烧的战船借助东风直冲曹军的木船,使曹军的木船燃起大火。根据图所示燃烧的条件填写:曹军的木船是,木船燃烧的条件是、。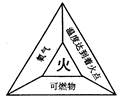
某气体是由SO2、H2、CO2中的一种或几种组成。现测知该气体中含氧质量分数为50%,则该气体的组成情况可能有:(1)__________;(2) __________ ;(3) __________。
某新型胃药的一个分子中含有5个氮原子,氮元素的质量分数约为16.5%,其相对分子质量为________(计算结果精确到0.1)。
康泰克以前是治疗感冒的常用药,因含PPA(苯丙醇胺)对人体有较大副作用而被禁用。PPA的化学式为C9H13ON,它由_________种元素组成,每个PPA分子中共含有_______个原子,其相对分子质量为_________(相对原子质量:H-1,C-12,N-14,O-16 )。