某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图,已知:Fe(OH)2、Fe(OH)3在常温下均为难溶于水的物质。请依据流程回答下列问题。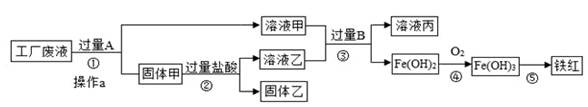
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)溶液甲中的溶质是 。
(3)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号)。
(4)写出步骤④氢氧化亚铁在溶液中反应生成氢氧化铁的化学方程式 。
(5)铁红是炼铁的主要原料,写出用CO和铁红炼铁的化学方程式 。
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
(1)请指出右图中所用仪器的名称:a______b______c______d______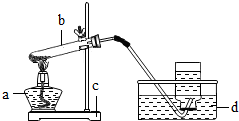
(2)他们所用的装置图中有一些错误,请你为他们指出来:
①
②
③
④
(3)用这种方法收集氧气时,当气泡____________再开始收集,收集满氧气后,应用玻璃片盖住集气瓶口,并且应____________(填“正放”或“倒放”)在桌上.
从分子的角度分析并解释下列问题
(1)墙内开花墙外可以闻到花香____________________________
(2)湿衣服在阳光下比在阴凉处干得快_____________________________
(3)6000L的氧气在加压的情况下可装入容积为40L的钢瓶中_____________________
(4)香水、汽油要密封保存。_________________________________
写出下列物质与氧气反应的文字表达式。
(1)铁______________________________________
(2)红磷_________________________________
(3)加热高锰酸钾制取氧气_______________________________
(4)分解过氧化氢制取氧气_______________________________
根据下列各粒子结构示意图,判断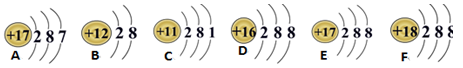
(1)属于原子的是__________
(2)属于阳离子的是___________
(3)属于阴离子的是____________
(4)达到稳定结构的是__________
(5)写出A代表的元素符号___________
写出下列化学符号:(1)二氧化硫_________;(2)二氧化碳__________;
(3)铁___________;(4)四氧化三铁__________;(5)高锰酸钾__________;