(15分)某工业废料钡泥中主要含有BaCO3、BaSO3、Ba(FeO2)2等,某实验小组模拟工业过程利用钡泥制取BaCO3和Ba(NO3)2晶体(不含结晶水),其实验流程如下: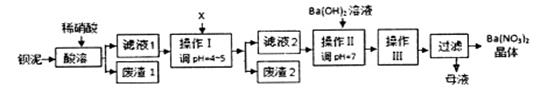
已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分虽为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃; Ba(NO3)2的溶解度在高温时较大,低温时较小;
③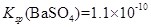 ,
,  .
.
(1)酸溶时,BaCO3发生反应的离子反应方程式为___________________________________
(2)酸溶后,滤液1除了Ba2+外,还存在的阳离子是____________________等(填写离子符号)。
(3)加入X的目的是_______________________________________________。
(4)若在操作II中加入Na2CO3来制取BaCO3,经检验所得BaCO3中含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌和静置后,弃去上层清液。如此反复多次处理,直到BaSO4全部转化为BaCO3,该提纯原理的离子反应方程式是_______________________________________
(5)若用(4)的方法处理含有0.21mol BaSO4样品,每次用1.0 L 2.0mol·L-1饱和Na2CO3溶液,则至少需要处理________次,BaSO4才能全部转化BaCO3。
(6)操作III的名称是:________、冷却结晶、_________、洗涤、干燥。
(7)上述流程中对环境的影响主要有_________。因此要进一步处理,避免造成二次污染。
可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液⑤结晶法⑥蒸发⑦萃取(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和CCl4的混合物
(5)除去 KCl 中少量 KClO3
(6)CCl4与甲苯的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75 ℃和110.6 ℃)
(7)提取NaCl和KNO3混合溶液中的KNO3
下图中各仪器的名称分别是:
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:
(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为。
(2)洗涤沉淀B的操作是_______________________________________
_________________________________________________________________。
(3)在整个实验过程中托盘天平至少使用_____次。
(4)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为_____________。
方案Ⅱ.乙组同学的主要实验流程图如下: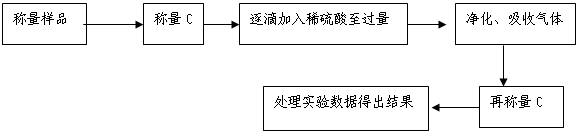
按如下图所示装置进行实验:
(5)该实验中装置B盛放的物质是_____________________,分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(6)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差____ __。(填“越大”、“越小”或“不变化”)
②D装置的作用是______________ _ _________。
(7)有的同学认为为了减少实验误差,在反应前后都要通人N2(如图),反应后通入N2的目的是。
(9分) 下图表示从固体混合物中分离X的2种方案,请回答有关问题。

(1)选用方案I时,X应该具有的性质是,残留物应该具有的性质是;
(2)选用方案Ⅱ从某混合物(含有Al2O3和MgO)中分离MgO,加入的试剂是,有关离子反应方程式为。
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。请回答:
(1)反应后所得的溶液漂白性增强的原因是。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有的溶质的化学式为。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
(3)实验结束后检测量筒收集到的气体除CO2外还混有O2,请写出I中产生O2的化学反应方程式。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是。