饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。请回答:
(1)反应后所得的溶液漂白性增强的原因是 。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有的溶质的化学式为 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
(3)实验结束后检测量筒收集到的气体除CO2外还混有O2,请写出I中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .

回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
(1)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________.
(2)硫酸镍溶于氨水形成[Ni(NH 3) 6]SO 4蓝色溶液.
①[Ni(NH 3) 6]SO 4中阴离子的立体构型是________.
②在[Ni(NH 3) 6]SO 4中Ni 2+与NH 3之间形成的化学键称为________,提供孤电子对的成键原子是________.
③氨的沸点________(填"高于"或"低于")膦(PH 3),原因是________;氨是________分子(填"极性"或"非极性"),中心原子的轨道杂化类型为________.
(3)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:I Cu=1 958kJ•mol ﹣ 1、I Ni=1 753kJ•mol ﹣ 1,I Cu>I Ni的原因是________.
(4)某镍白铜合金的立方晶胞结构如图所示

①晶胞中铜原子与镍原子的数量比为________.
②若合金的密度为d g•cm ﹣ 3,晶胞参数a=________nm.
双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
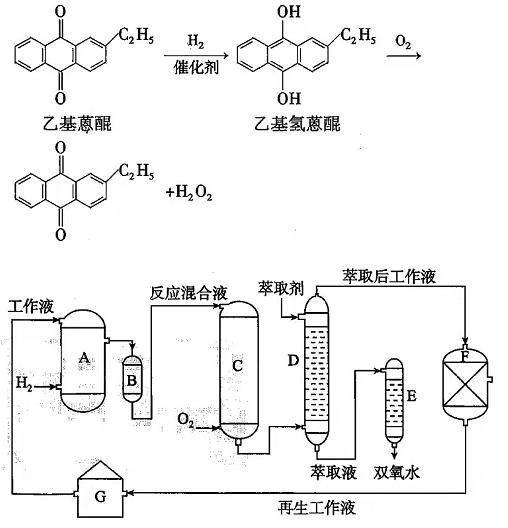
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H 2O 2理论上消耗的原料是________,循环使用的原料是________,配制工作液时采用有机溶剂而不采用水的原因是________.
(2)氢化物A中反应的化学方程式为________.进入氧化塔C的反应混合液中的主要溶质为________.
(3)萃取塔D中的萃取剂是________,选择其作萃取剂的原因是________.
(4)工作液再生装置F中要除净残留的H 2O 2, 原因是________.
(5)双氧水浓度可在酸性条件下用KMnO 4溶液测定,该反应的离子方程式为________,一种双氧水的质量分数为27.5%(密度为1.10g•cm ﹣ 3),其浓度为________mol•L ﹣ 1.
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
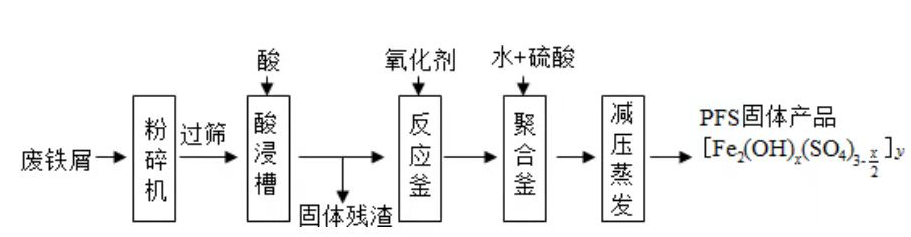
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________.粉碎过筛的目的是________.
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式________.
(3)反应釜中加入氧化剂的作用是________,下列氧化剂中最合适的是________(填标号).
| A. |
|
B. |
|
C. |
|
D. |
|
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时 水解程度弱,pH偏大时则________.
(5)相对于常压蒸发,减压蒸发的优点是________.
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为 (n为物质的量).为测量样品的B值,取样品 ,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液 .按上述步骤做空白对照试验,消耗NaOH溶液 ,已知该样品中Fe的质量分数w,则B的表达式为________.
煤燃烧排放的烟含有 和 , 形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1) 的化学名称为________.
(2)在鼓泡反应器中通入含 、 的烟气,反应温度323K, 溶液浓度为 . 反应一段时间后溶液中离子浓度的分析结果如表.
|
离子 |
|
|
|
|
|
|
c/ |
|
|
|
|
|
①写出 溶液脱硝过程中主要反应的离子方程式________.增加压强,NO的转化率________(填"提高"、"不变"或"降低").
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填"增大"、"不变"或"减小").
③由实验结果可知,脱硫反应速率________脱硝反应速率(填"大于"或"小于")原因是除了 和NO在烟气中初始浓度不同,还可能是________.
(3)在不同温度下, 溶液脱硫、脱硝的反应中 和NO的平衡分压 如图所示.
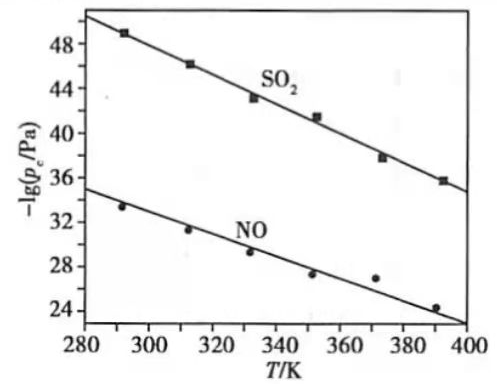
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______(填"增大"、"不变"或"减小").
②反应 的平衡常数K表达式为________.
(4)如果采用 、 替代 ,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析, 相比 具有的优点是________.
②已知下列反应:
则反应 (aq)的△H=________.