煤燃烧排放的烟含有 和 , 形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1) 的化学名称为________.
(2)在鼓泡反应器中通入含 、 的烟气,反应温度323K, 溶液浓度为 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 |
|
|
|
|
|
c/ |
|
|
|
|
|
①写出 溶液脱硝过程中主要反应的离子方程式________.增加压强,NO的转化率________(填"提高"、"不变"或"降低").
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填"增大"、"不变"或"减小").
③由实验结果可知,脱硫反应速率________脱硝反应速率(填"大于"或"小于")原因是除了 和NO在烟气中初始浓度不同,还可能是________.
(3)在不同温度下, 溶液脱硫、脱硝的反应中 和NO的平衡分压 如图所示.
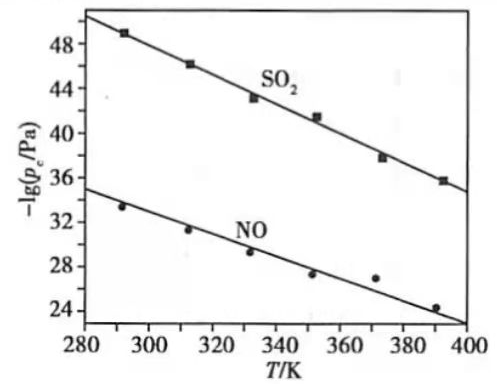
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______(填"增大"、"不变"或"减小").
②反应 的平衡常数K表达式为________.
(4)如果采用 、 替代 ,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析, 相比 具有的优点是________.
②已知下列反应:
则反应 (aq)的△H=________.
铁、铝、铜等金属及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是;X与过量浓硝酸反应后溶液中含有的盐的化学式,检验该盐溶液中含有的阳离子的试剂为________________
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸,所得溶液与原溶液相比,溶液中大量减少的阳离子是________
A.Mg2+ B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
①操作Ⅰ的名称是,操作Ⅱ的名称是;
操作操作Ⅱ的方法为_____________________________________________________________
_______________________________________________________________________________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示);
③请完成生成FeCO3沉淀的离子方程式:Fe2+ + HCO3- FeCO3↓+ + H2O
(4)有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===
5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除
天平、玻璃棒、烧杯、胶头滴管外,还需。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
③某同学设计的下列滴定方式,最合理的是(夹持部分略去)(填字母序号)
(Ⅰ)下列实验操作或实验叙述正确的是()
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为______________________。
(2)洗涤所得沉淀的实验操作方法:_____________________________________________
(Ⅲ)若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。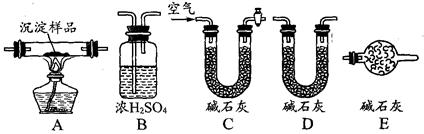
(1)实验装置的连接顺序为_________________________________
(2)装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
(3)若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________
(Ⅰ)下列实验操作或实验叙述正确的是()
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
(Ⅱ)红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式___________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
已知: ,则实验选择的最简单的装置接口连接顺序为________;
,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H="-393.5" kJ·mol -1 ;CO(g)+ O2(g)=CO2(g),△H="-283.0" kJ·mol -1,写出CO2和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H="-283.0" kJ·mol -1,写出CO2和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
(1 6分)某化学兴趣小组用铝土矿(主要成分为A12 03,还含有Si02及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置
(填字母代号)。
(2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有;
洗涤沉淀的操作是
(3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:
此方案中所用药品的物质的量之比是: =。
=。
(4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,
加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由。